2023年4月28日����,上海市藥品監(jiān)督管理局發(fā)布2022年度第二類有源醫(yī)療器械首次注冊技術(shù)審評常見問題分析�,2022年上海市醫(yī)療器械化妝品審評核查中心共計受理第二類有源醫(yī)療器械首次注冊92件�,其中91件進行了發(fā)補,最常見的問題為:產(chǎn)品技術(shù)要求�����、研究資料�、綜述資料。一起來了解上海市第二類有源醫(yī)療器械注冊審評常見問題有哪些���。
2023年4月28日����,上海市藥品監(jiān)督管理局發(fā)布2022年度第二類有源醫(yī)療器械首次注冊技術(shù)審評常見問題分析�,2022年上海市醫(yī)療器械化妝品審評核查中心共計受理第二類有源醫(yī)療器械首次注冊92件,其中91件進行了發(fā)補��,最常見的問題為:產(chǎn)品技術(shù)要求����、研究資料、綜述資料���。一起來了解上海市第二類有源醫(yī)療器械注冊審評常見問題有哪些��。
一����、上海第二類醫(yī)療器械注冊(首次注冊)審評發(fā)補意見分布情況
91件首次注冊發(fā)補涉及68家企業(yè)���,發(fā)補意見主要集中在綜述資料�����、研究資料���、臨床評價、產(chǎn)品技術(shù)要求和產(chǎn)品說明書五部分(見圖一)�����,其中綜述資料發(fā)補率67%�����,研究資料發(fā)補率90.2%��,臨床評價發(fā)補率62%,產(chǎn)品技術(shù)要求發(fā)補率93%�����,產(chǎn)品說明書發(fā)補率62%�。
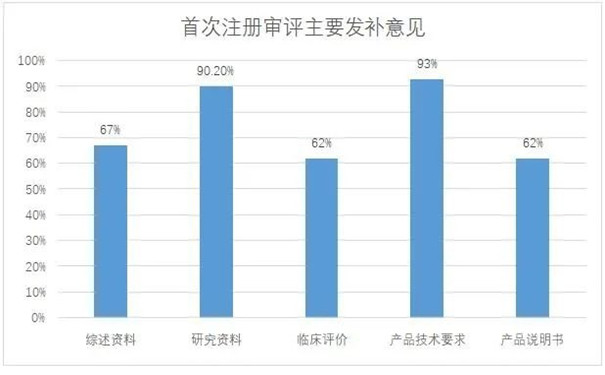
圖一:首次注冊審評主要發(fā)補意見分布情況
二、首次注冊審評常見問題分析
1�����、注冊單元及產(chǎn)品管理類別問題
根據(jù)《醫(yī)療器械注冊單元劃分指導原則》�����,產(chǎn)品技術(shù)原理����、結(jié)構(gòu)組成、性能指標��、適用范圍不同時����,原則上劃分為不同注冊單元。例如電子鼻咽喉鏡�,需要詳述不同型號的差異���,包括原材料、結(jié)構(gòu)組成等����,用于判斷是否為同一注冊單元。部分產(chǎn)品管理類別不明確�,有些產(chǎn)品屬于三類醫(yī)療器械或不屬于醫(yī)療器械�����,需進行分類界定��,建議企業(yè)在提交資料前進行分類界定明確產(chǎn)品管理類別����。
2、綜述資料常見問題
企業(yè)應(yīng)當根據(jù)《關(guān)于公布醫(yī)療器械注冊申報資料要求和批準證明文件格式的公告》���,編寫申報產(chǎn)品的綜述資料�,存在主要問題如下:
(1)產(chǎn)品作用機理:未詳細描述產(chǎn)品的工作原理����,未提供產(chǎn)品的工作原理圖����,未描述功能的具體實現(xiàn)方式��;產(chǎn)品原理的描述與產(chǎn)品檢驗報告中的描述不一致����。
(2)結(jié)構(gòu)組成:未明確具體描述產(chǎn)品的結(jié)構(gòu)組成(包括附件、選配件)�����;未提供各部件的詳細規(guī)格����;未提供內(nèi)部結(jié)構(gòu)示意圖和電路圖及說明(如,部件照片�����、軟件的界面����、功能、輸出報告描述)��;產(chǎn)品結(jié)構(gòu)組成與提供的產(chǎn)品照片中的組成不一致;未對不同型號的產(chǎn)品在結(jié)構(gòu)組成上的差異進行詳細描述�。
(3)型號規(guī)格:未明確申報的產(chǎn)品型號和包含的部件型號之同的配置關(guān)系;對于存在多型號規(guī)格(配置)的產(chǎn)品�,未明確產(chǎn)品型號劃分、未明確各型號規(guī)格的區(qū)別和差異(如:結(jié)構(gòu)�����、功能�����、性能指標等)�;對申報產(chǎn)品中在結(jié)構(gòu)特征上有明顯區(qū)別的產(chǎn)品����,企業(yè)未在產(chǎn)品型號命名規(guī)則上予以區(qū)分。
(4)適用范圍:未明確適用范圍����;產(chǎn)品適用范圍超出《醫(yī)療器械分類目錄》中對于相應(yīng)分類的描述;產(chǎn)品適用范圍的表述與配用主機的適用范圍表述不一致����;特定產(chǎn)品適用范圍的內(nèi)容中未明確適用人群的范圍���,如年齡、體重等要求��。
(5)軟件相關(guān):軟件功能表述不清晰��,相關(guān)功能的臨床用途和意義不明確����;未按照軟件指導原則規(guī)范制定軟件發(fā)布版本與版本軟件命名規(guī)則;未明確軟件算法����、數(shù)學模型的原理和臨床依據(jù),包括計算分析處理過程等內(nèi)容���;軟件描述文檔未按照《醫(yī)療器械軟件注冊審查技術(shù)指導原則》(2022年修訂版)進行完善��;未詳細描述軟件所有的交付內(nèi)容和形式���;未對軟件安裝和部署方式進行介紹;未詳細描述軟件架構(gòu)(如BS�����、CS)的實現(xiàn)方式;未對軟件中使用的現(xiàn)成軟件進行介紹����。
3、研究資料常見問題
(1)性能研究:提供的產(chǎn)品性能指標��、產(chǎn)品技術(shù)要求的編制說明的確定依據(jù)不清晰不明確����;強制性標準內(nèi)容引用不完整,對不適用條款未給出不適用的理由�;例如心電記錄儀未詳細說明產(chǎn)品對強制性標準YY0885各條款的符合性,未對不適用條款給出理由����。
(2)軟件研究:應(yīng)按照《醫(yī)療器械軟件注冊審查指導原則(2022年修訂版)》《醫(yī)療器械網(wǎng)絡(luò)安全注冊審查指導原則(2022年修訂版)》提交產(chǎn)品軟件研究資料和網(wǎng)絡(luò)安全資料���,存在主要問題如下:①未對軟件安全級別進行詳細描述�,安全級別判定理由不合理�,未根據(jù)軟件安全性級別提交相應(yīng)資料;②軟件核心功能���、核心算法描述過于簡單��,缺少測量準確性研究和驗證資料��;③軟件描述文檔中軟件版本信息與檢驗報告不一致��。④錯誤認定產(chǎn)品不含軟件或不涉及網(wǎng)絡(luò)安全��。
(3)生物學研究:研究存在的主要問題有:未考慮微生物性能���,未明確與患者及使用者接觸部件的材料性質(zhì)等��。
(4)有效期和包裝研究:存在的主要問題有:未根據(jù)產(chǎn)品特點合理選擇使用期限評價路徑�����,評價方法不清晰��;有效期研究資料中未見部分不可更換部件使用壽命相關(guān)資料�。
4��、臨床評價資料常見問題
(1)免臨床評價目錄(以下簡稱目錄)內(nèi)產(chǎn)品:與境內(nèi)已注冊產(chǎn)品的對比不全面�,未考慮主要性能指標、軟件功能等方面差異�����;對工作原理、結(jié)構(gòu)組成���、實現(xiàn)方式等顯著性差異分析不充分���,不能證明兩者具有基本等同性;缺少對比產(chǎn)品注冊批件或說明書等支持性資料��。
(2)通過同品種器械開展評價:如提交的同品種產(chǎn)品臨床數(shù)據(jù)欠缺可比性和充分性��,未充分考慮適用范圍���、技術(shù)特征以及生物學特性的差異�,不能證明兩者具有廣泛相似性�;提交的臨床文獻中缺少同品種產(chǎn)品信息,未說明兩者相關(guān)性����;臨床文獻無實質(zhì)內(nèi)容��,也未開展對比測試或驗證����;未對文獻數(shù)據(jù)進行分析����,也未評估其對申報產(chǎn)品性能與安全性論證的貢獻�����。
(3)通過臨床試驗開展評價:如臨床試驗過程中對申報器械的使用操作與產(chǎn)品說明書不完全一致���,未給出解釋����;適用范圍描述有待規(guī)范�����,臨床試驗評價指標與企業(yè)主張的臨床適用范圍有顯著差異��;有效性評價采用評分表形式�����,但未提供確立依據(jù)��;未對剔除病例、離群值進行合理分析���;適應(yīng)癥表述不清晰不明確��,未闡述不同病種病例數(shù)的統(tǒng)計學考慮���。
5、產(chǎn)品技術(shù)要求常見問題
產(chǎn)品技術(shù)要求遵循的原則有《醫(yī)療器械產(chǎn)品技術(shù)要求編寫指導原則》���、適用的強制性國家/行業(yè)標準�����、推薦性國家/行業(yè)標準(推薦采用)�����。產(chǎn)品技術(shù)要求存在問題:
(1)缺少部分性能指標�、指標不合理��;
(2)缺少軟件功能���,軟件功能描述不清晰����;
(3)軟件版本����、命名規(guī)則不完整、缺少典型運行環(huán)境��;
(4)附錄中缺少必要的內(nèi)容����,如缺少非標體模,工裝����、測試軟件等信息;
(5)檢驗方法不合理�����,不明確��;
(6)編寫不規(guī)范����,如缺少標準年代號��、未按最新版《醫(yī)療器械產(chǎn)品技術(shù)要求編寫指導原則》編寫�����;
(7)引用標準的問題�,如標準條款引用不全���,未識別出產(chǎn)品適用的標準����;
(8)結(jié)構(gòu)組成不完整��、型號規(guī)格劃分不清晰�。
6、產(chǎn)品說明書常見問題
醫(yī)療器械產(chǎn)品說明書可參考以下具體文件《醫(yī)療器械說明書和標簽管理規(guī)定》��、標準(強標��、專標)及注冊技術(shù)審查指導原則對說明書的要求��。常見問題如下:
(1)說明書中描述內(nèi)容與綜述資料���、研究資料不一致�;
(2)說明書中性能指標與產(chǎn)品技術(shù)要求不一致;
(3)未涵蓋《醫(yī)療器械說明書和標簽管理規(guī)定》中要求的內(nèi)容或描述不清晰��。
(4)說明書內(nèi)容未在技術(shù)要求中體現(xiàn)
(5)未涵蓋注冊技術(shù)審查指導原則及國標行標中要求的內(nèi)容�����。
7����、醫(yī)療器械注冊檢驗報告常見問題
送檢樣品應(yīng)為成品��,檢驗報告上條款應(yīng)與產(chǎn)品技術(shù)要求一致��,并在具備醫(yī)療器械檢驗資質(zhì)的檢驗機構(gòu)進行注冊檢驗����。常見問題如下:
(1)送檢樣品不能覆蓋所有型號規(guī)格,除選擇典型型號進行全性能檢驗外���,還應(yīng)選擇其他型號進行差異性檢驗����;
(2)提交的經(jīng)檢測機構(gòu)蓋章的產(chǎn)品技術(shù)要求與注冊提交的產(chǎn)品技術(shù)要求不一致�����。
(3)以注冊人形式申報的產(chǎn)品,檢驗報告中的制造商與申報資料不一致���。
三�����、 對上海市第二類有源醫(yī)療器械首次注冊的建議
本文對2022年上海市第二類有源醫(yī)療器械首次注冊常見發(fā)補問題進行了梳理與分析���,其中最常見的問題為:產(chǎn)品技術(shù)要求、研究資料�����、綜述資料���。
在產(chǎn)品技術(shù)要求部分����,應(yīng)按照《醫(yī)療器械產(chǎn)品技術(shù)要求編寫指導原則》撰寫產(chǎn)品技術(shù)要求����,注重產(chǎn)品技術(shù)要求編寫的規(guī)范性����。醫(yī)療器械產(chǎn)品應(yīng)當符合醫(yī)療器械強制性國家標準和強制性行業(yè)標準��。產(chǎn)品技術(shù)要求中包含的性能指標要完善����,并覆蓋產(chǎn)品的功能���,否則可能會涉及補檢���。
關(guān)于研究資料,建議企業(yè)根據(jù)《關(guān)于公布醫(yī)療器械注冊申報資料要求和批準證明文件格式的公告》進行編寫�,根據(jù)申報產(chǎn)品適用范圍和技術(shù)特征,提供研究綜述�,逐項描述所開展的研究,提供相應(yīng)的研究資料��。研究資料應(yīng)當包括產(chǎn)品性能指標的確定依據(jù)��、設(shè)計輸入來源等內(nèi)容����。研究資料應(yīng)當足夠充分�����,能夠證明產(chǎn)品的安全性和有效性�����。特別對于包含軟件組件的產(chǎn)品�,應(yīng)當根據(jù)《醫(yī)療器械軟件注冊審查指導原則(2022年修訂版)》的要求提交產(chǎn)品軟件研究資料�����,如涉及網(wǎng)絡(luò)安全���,還應(yīng)根據(jù)《醫(yī)療器械網(wǎng)絡(luò)安全注冊審查指導原則(2022年修訂版)》的要求提供相應(yīng)網(wǎng)絡(luò)安全研究資料���。
綜述資料部分,企業(yè)應(yīng)當詳細描述產(chǎn)品的工作原理��、結(jié)構(gòu)組成���、適用范圍�、功能的具體實現(xiàn)方式等內(nèi)容,讓審評人員對產(chǎn)品能有整體的把握和了解�,使產(chǎn)品的風險能更清晰地被識別。
關(guān)于說明書和標簽����,企業(yè)應(yīng)認真研讀《醫(yī)療器械說明書和標簽管理規(guī)定》,按規(guī)定編制說明書和標簽�,規(guī)范表述產(chǎn)品規(guī)格型號、適用范圍���、適用人群���、注意事項和禁忌癥等���。說明書與研究資料����、產(chǎn)品技術(shù)要求等其他申報資料的內(nèi)容要保持一致���。