《醫(yī)療器械注冊與備案管理辦法》(國家市場監(jiān)督管理總局令第47號(hào))第八條:第一類醫(yī)療器械實(shí)行備案管理,第二類��、第三類醫(yī)療器械實(shí)行注冊管理���。境內(nèi)第二類醫(yī)療器械由省���、自治區(qū)、直轄市食品藥品監(jiān)督管理部門審查�,批準(zhǔn)后發(fā)給醫(yī)療器械注冊證。本文為大家介紹云南第二類醫(yī)療器械注冊流程�����、時(shí)間和申報(bào)資料要求。
引言:《醫(yī)療器械監(jiān)督管理?xiàng)l例》(國務(wù)院令第739號(hào))第十三條:第一類醫(yī)療器械實(shí)行產(chǎn)品備案管理�����,第二類��、第三類醫(yī)療器械實(shí)行產(chǎn)品注冊管理����。第十六條:申請第二類體外診斷試劑產(chǎn)品注冊,注冊申請人應(yīng)當(dāng)向所在地省���、自治區(qū)、直轄市人民政府食品藥品監(jiān)督管理部門提交注冊申請資料��。 《醫(yī)療器械注冊與備案管理辦法》(國家市場監(jiān)督管理總局令第47號(hào))第八條:第一類醫(yī)療器械實(shí)行備案管理����,第二類、第三類醫(yī)療器械實(shí)行注冊管理��。境內(nèi)第二類醫(yī)療器械由省�、自治區(qū)、直轄市食品藥品監(jiān)督管理部門審查,批準(zhǔn)后發(fā)給醫(yī)療器械注冊證���。本文為大家介紹云南第二類醫(yī)療器械注冊流程�、時(shí)間和申報(bào)資料要求�。
一、云南第二類醫(yī)療器械注冊流程:
云南第二類醫(yī)療器械注冊流程與其他省市基本一致��,包括企業(yè)前期準(zhǔn)備����、醫(yī)療器械質(zhì)量管理體系建設(shè)、產(chǎn)品研發(fā)定型��、制造與質(zhì)量保證能力具備��、醫(yī)療器械注冊檢驗(yàn)��、醫(yī)療器械注冊申請�、省藥監(jiān)局技術(shù)審評(píng)和注冊質(zhì)量管理體系考核、補(bǔ)正�、獲得醫(yī)療器械注冊證、申請醫(yī)療器械生產(chǎn)許可證這些關(guān)鍵事項(xiàng)����。
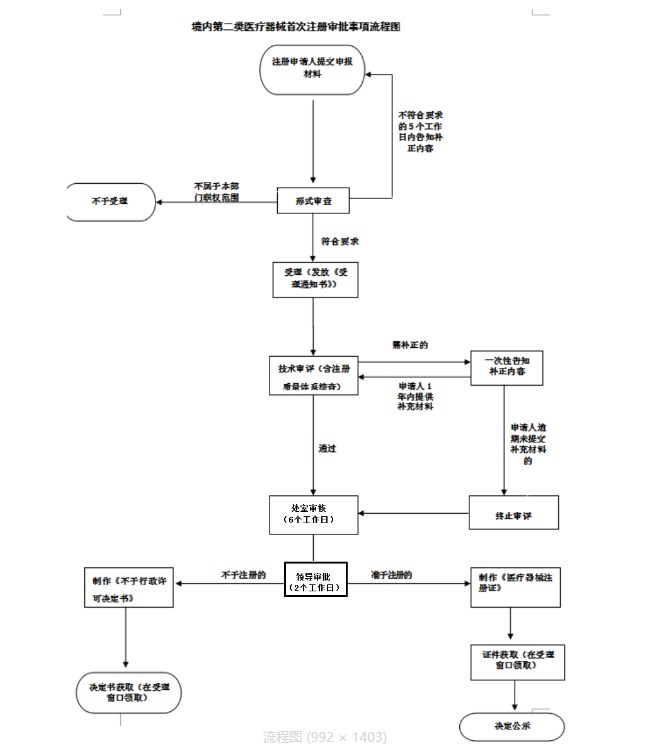
藥監(jiān)局醫(yī)療器械注冊審評(píng)審批流程如下:

云南第二類醫(yī)療器械注冊流程圖如下:
二、云南第二類醫(yī)療器械注冊時(shí)間
昨日與云南省醫(yī)療器械注冊審評(píng)審批領(lǐng)導(dǎo)交流,云南省藥監(jiān)局于2022年推出加快云南醫(yī)藥審批20條����,致力于優(yōu)化醫(yī)療器械注冊審評(píng)審批流程,提高云南第二類醫(yī)療器械注冊審評(píng)審批效率����。
盡管不同產(chǎn)品對(duì)應(yīng)的醫(yī)療器械注冊時(shí)間存在較大差異,但是主管領(lǐng)導(dǎo)的努力��,及企業(yè)和第三方醫(yī)療器械注冊服務(wù)機(jī)構(gòu)的專業(yè)度�,將幫助企業(yè)縮短產(chǎn)品注冊時(shí)間,提高醫(yī)療器械注冊上市效率��。
三�����、云南第二類醫(yī)療器械注冊申報(bào)資料要求
云南第二類醫(yī)療器械注冊申報(bào)資料主要包括如下:
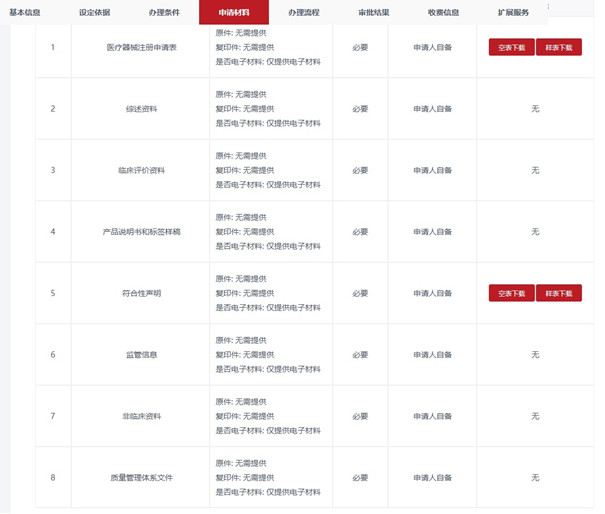
但考慮到國家局2022年開始推行新的醫(yī)療器械注冊申報(bào)資料要求及文件目錄結(jié)構(gòu)�����,預(yù)計(jì)云南第二類醫(yī)療器械注冊申報(bào)資料在不久的將來會(huì)與其它省市趨于一致�。
更多有關(guān)云南第二類醫(yī)療器械注冊服務(wù)需求��,歡迎您隨時(shí)方便與杭州證標(biāo)客醫(yī)藥技術(shù)咨詢有限公司聯(lián)絡(luò)。聯(lián)系人:葉工�����,電話:18058734169�����,微信同��。