5月6日國家藥品監(jiān)督管理局官網(wǎng)發(fā)布《國家藥監(jiān)局綜合司關(guān)于印發(fā)2019年國家醫(yī)療器械抽檢產(chǎn)品檢驗方案的通知》(下稱《通知》),向各省���、自治區(qū)�、直轄市藥品監(jiān)督管理局印發(fā)2019年國家醫(yī)療器械抽檢產(chǎn)品檢驗方案����。
意味著,根據(jù)此前國家藥監(jiān)局印發(fā)的《國家藥監(jiān)局關(guān)于開展2019年國家醫(yī)療器械抽檢工作的通知》要求����,2019醫(yī)療器械抽檢工作全面啟動。
國家藥監(jiān)局近日發(fā)通知,全國醫(yī)療器械抽檢工作啟動����,抽檢方案印發(fā)���。
5月6日��,國家藥品監(jiān)督管理局官網(wǎng)發(fā)布《國家藥監(jiān)局綜合司關(guān)于印發(fā)2019年國家醫(yī)療器械抽檢產(chǎn)品檢驗方案的通知》(下稱《通知》)�,向各省���、自治區(qū)�、直轄市藥品監(jiān)督管理局印發(fā)2019年國家醫(yī)療器械抽檢產(chǎn)品檢驗方案����。
這意味著,根據(jù)此前國家藥監(jiān)局印發(fā)的《國家藥監(jiān)局關(guān)于開展2019年國家醫(yī)療器械抽檢工作的通知》要求�,2019醫(yī)療器械抽檢工作全面啟動。
國家藥監(jiān)局在《通知》中要求�����,各省自治區(qū)直轄市藥監(jiān)局要按照《2019年國家醫(yī)療器械抽檢(中央補助地方項目)產(chǎn)品檢驗方案》���、《2019年國家醫(yī)療器械抽檢(國家級預(yù)算項目)產(chǎn)品檢驗方案》組織相關(guān)檢驗機構(gòu)按醫(yī)療器械強制性標(biāo)準(zhǔn)以及經(jīng)醫(yī)療器械注冊或者備案的產(chǎn)品技術(shù)要求(注冊產(chǎn)品標(biāo)準(zhǔn))開展檢驗工作���。
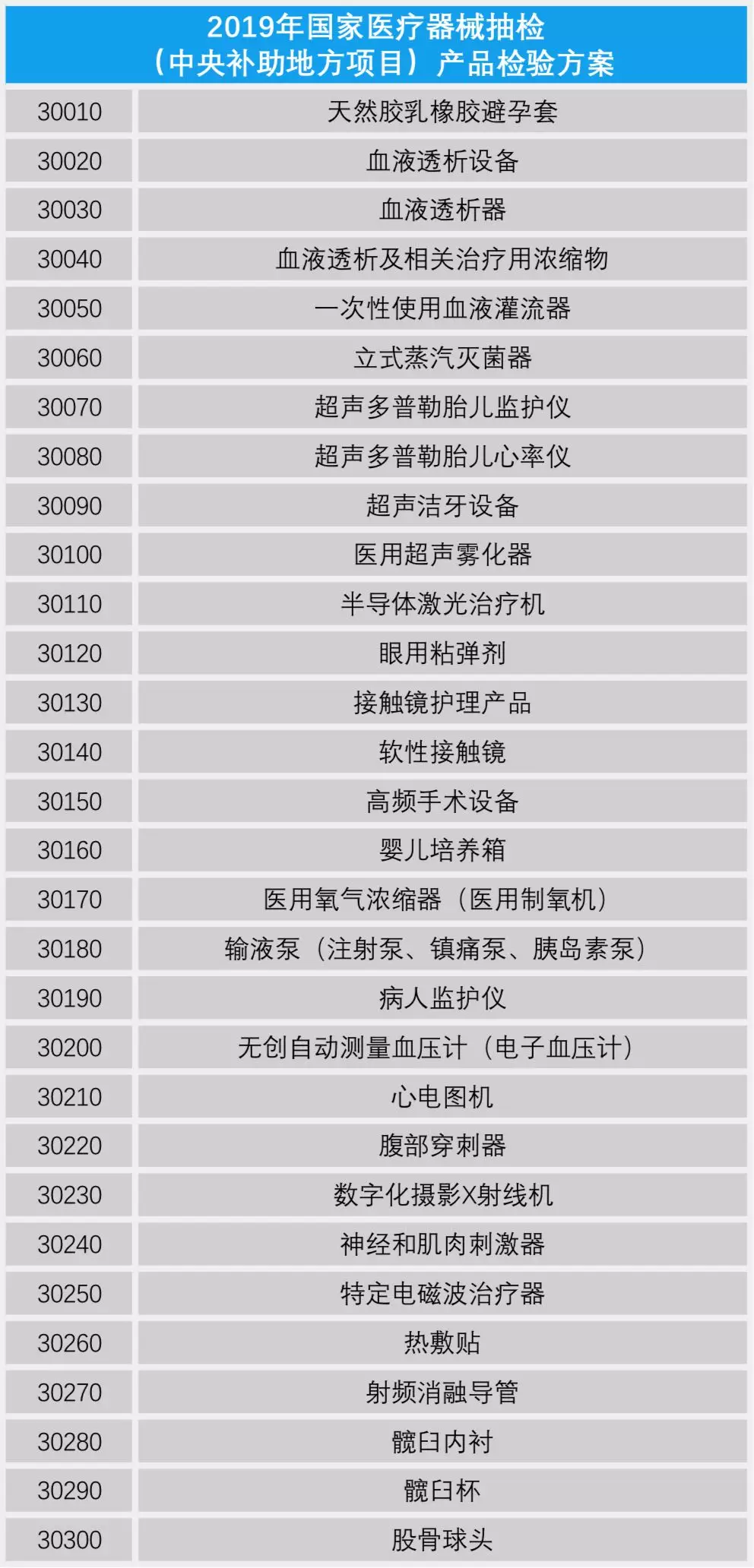
證標(biāo)客整理了上述兩個產(chǎn)品檢驗方案�,共計59類醫(yī)療器械產(chǎn)品列入抽檢范圍�,包括中央補助地方項目中的病人監(jiān)護儀、心電圖機�、腹部穿刺器和血糖儀等49類產(chǎn)品;以及國家級預(yù)算項目中的移動式X射線機和多類檢測試劑盒等10類產(chǎn)品�����。(具體產(chǎn)品詳見下文)
對于產(chǎn)品抽檢項目的判定原則�,上述產(chǎn)品檢驗方案顯示,所抽檢項目任意項判定為不合格�����,則本次抽檢綜合結(jié)論為不合格��。同時���,樣品在正常檢驗過程中不能正常使用����,本次抽檢綜合結(jié)論為不合格。
產(chǎn)品抽檢旨在加強上市后醫(yī)療器械產(chǎn)品的質(zhì)量監(jiān)管���。據(jù)悉�,2019年3月5日至7日�����,在廣州召開的2019年國家醫(yī)療器械抽檢工作座談會上���,國家局醫(yī)療器械監(jiān)管司司長王者雄表示,國家醫(yī)療器械抽檢工作還存在各種問題和挑戰(zhàn)�,要求各單位精心組織、整合全國醫(yī)療器械抽檢資源�,規(guī)范行為,狠抓嚴(yán)管��,做好不合格產(chǎn)品召回信息發(fā)布及工作總結(jié)的報送工作���。
此次國家藥監(jiān)局的抽檢工作通知中也明確了復(fù)檢工作以及推薦復(fù)檢機構(gòu)名單���。
復(fù)檢工作上,被抽樣單位或標(biāo)示生產(chǎn)企業(yè)(下簡稱申請人)對檢驗結(jié)論有異議的����,可以自收到檢驗報告之日起7個工作日內(nèi)向相應(yīng)的醫(yī)療器械檢驗機構(gòu)提出復(fù)檢申請��。為保證復(fù)檢效果�����,申請人可以優(yōu)先從2019年國家醫(yī)療器械抽檢復(fù)檢機構(gòu)推薦名單中選擇���。復(fù)檢機構(gòu)應(yīng)及時受理復(fù)檢申請并開展檢驗工作。逾期未申請復(fù)檢的����,視為申請人認(rèn)可該檢驗結(jié)果,檢驗機構(gòu)不再受理復(fù)檢申請���。
同時�����,在異議申訴上��,《通知》顯示��,被抽樣單位或標(biāo)示生產(chǎn)企業(yè)對檢驗方法���、判定依據(jù)等存在異議��,且無法通過復(fù)檢進行驗證的����,應(yīng)當(dāng)自收到檢驗報告之日起7個工作日內(nèi)�����,向所在地省局提出異議申訴書面申請���,并提交相關(guān)證明材料。
所在地省局應(yīng)當(dāng)在收到申請后2個工作日內(nèi)���,將異議申訴情況填報至國家醫(yī)療器械抽檢信息系統(tǒng)�����,并在15個工作日內(nèi)進行調(diào)查核實�����、確認(rèn)核實結(jié)果�����,提出處理建議報中國食品藥品檢定研究院技術(shù)監(jiān)督中心��。相關(guān)省局未進行調(diào)查審核���、未提出核實結(jié)果和處理建議的的�,有關(guān)材料將予以退回��。逾期未提出異議或者未提供有效證明材料的����,視為申請人認(rèn)可該檢驗結(jié)果。