江蘇省局認證審評中心關于醫(yī)療器械注冊補充資料超期產(chǎn)品終止技術審評的通告
發(fā)布日期:2019-06-03 00:00瀏覽次數(shù):3753次
根據(jù)《醫(yī)療器械注冊管理辦法》第三十五條及《體外診斷試劑注冊管理辦法》第四十五條的相關規(guī)定���,技術審評過程中���,需要申請人補正資料的,提交補充資料的時限為1年��。
根據(jù)《醫(yī)療器械注冊管理辦法》第三十五條及《體外診斷試劑注冊管理辦法》第四十五條的相關規(guī)定�,技術審評過程中,需要申請人補正資料的����,提交補充資料的時限為1年。申請人逾期未提交補充資料的��,由技術審評機構終止技術審評���,提出不予注冊的建議,由食品藥品監(jiān)督管理部門核準后作出不予注冊的決定�。
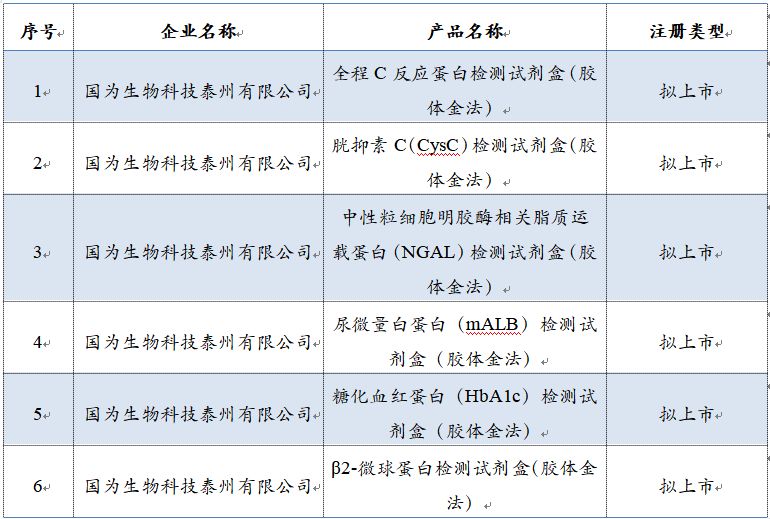
經(jīng)清理核實,截止2019年5月27日���,以下 6個產(chǎn)品(含擬上市注冊產(chǎn)品)仍未按規(guī)定提交補充資料���,時間已經(jīng)超過1年�,我中心擬終止技術審評�����,提出不予注冊的建議�����,上報江蘇省藥品監(jiān)督管理局(產(chǎn)品清單見附件)��。
附件:擬終止技術審評產(chǎn)品清單
江蘇省食品藥品監(jiān)督管理局認證審評中心
2019年5月27日
附件:擬終止技術審評產(chǎn)品清單