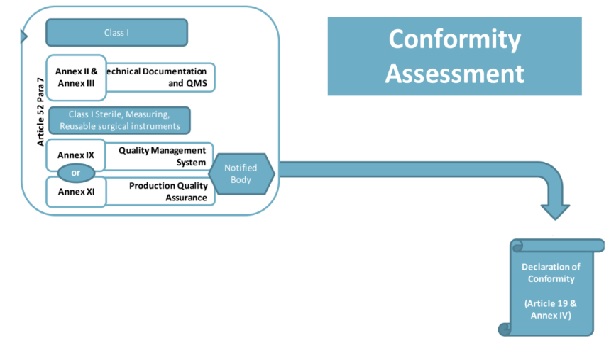
歐盟一類醫(yī)療器械CE認(rèn)證需要技術(shù)文件嗎
發(fā)布日期:2021-05-25 23:20瀏覽次數(shù):2237次
明天是2021年5月26日�,是歐盟醫(yī)療器械法規(guī)MDR EU 2017/745因新冠疫情推遲一年后正式實(shí)施的日期。對于一類醫(yī)療器械��,很多客戶類比成國內(nèi)備案,認(rèn)為非常簡單��。從專業(yè)角度來看����,一類醫(yī)療器械CE認(rèn)證?與國內(nèi)備案有先溝通之處,但也存在較大差異�����。
引言:明天是2021年5月26日�,是歐盟醫(yī)療器械法規(guī)MDR EU 2017/745因新冠疫情推遲一年后正式實(shí)施的日期。對于一類醫(yī)療器械��,很多客戶類比成國內(nèi)備案�,認(rèn)為非常簡單��。從專業(yè)角度來看����,一類醫(yī)療器械CE認(rèn)證與國內(nèi)備案有先溝通之處,但也存在較大差異�����。
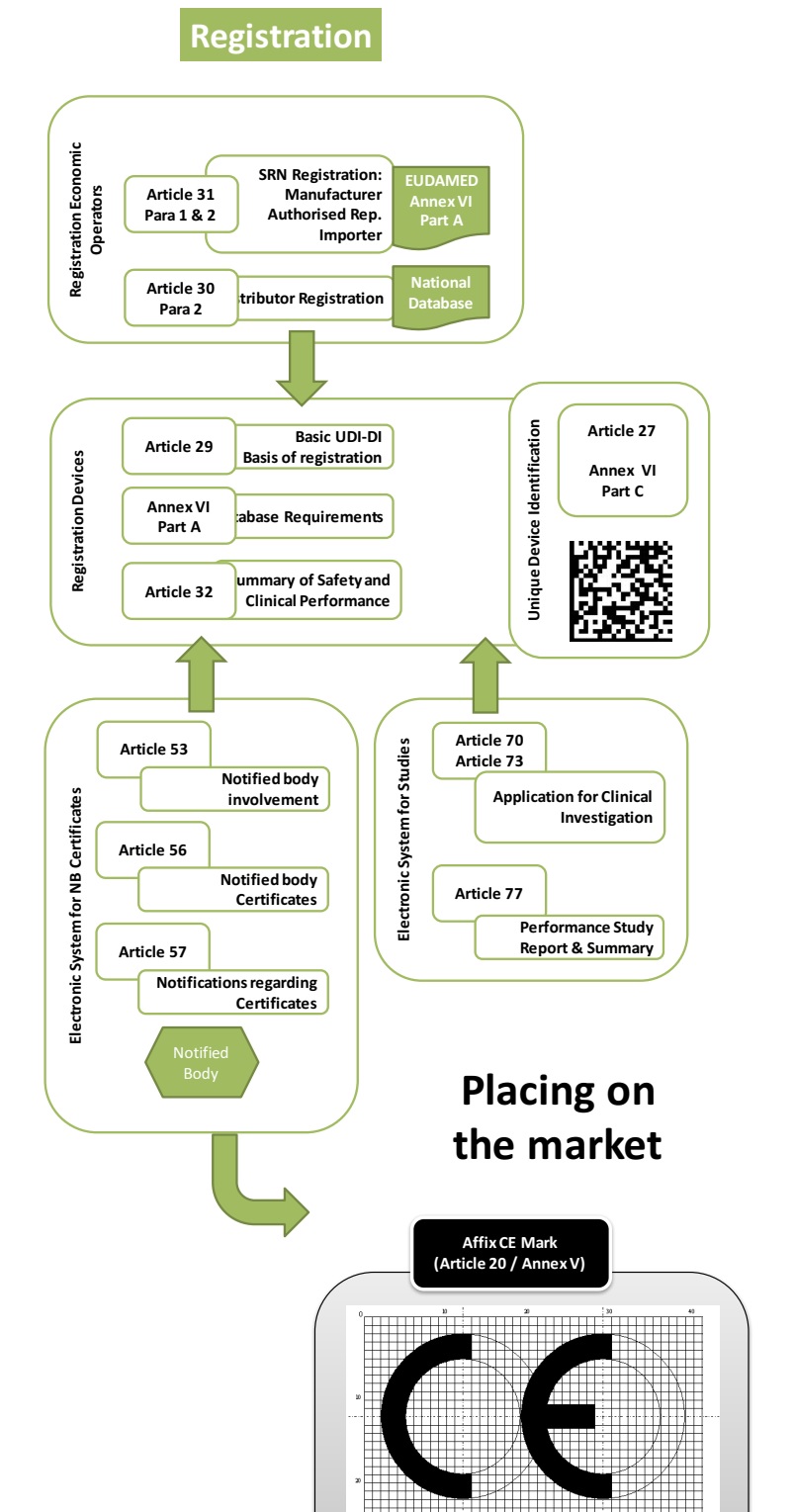
按照MDR的規(guī)定,對于自我宣告類器械��,需要指定歐盟授權(quán)代表并完成器械注冊后���,才可以合法加貼CE標(biāo)志并上市銷售���。下圖是歐盟醫(yī)療器械注冊流程圖: