輸尿管支架在我國屬于第二類醫(yī)療器械注冊?產品�,通常由硅橡膠�、聚氨酯或其他聚合物制造���。產品放置于腎盂與膀胱之間��,用于對人體輸尿管進行支撐和引流����。一起來了解輸尿管支架注冊要求�。
輸尿管支架在我國屬于第二類醫(yī)療器械注冊產品�����,通常由硅橡膠���、聚氨酯或其他聚合物制造��。產品放置于腎盂與膀胱之間����,用于對人體輸尿管進行支撐和引流�����。一起來了解輸尿管支架注冊要求。
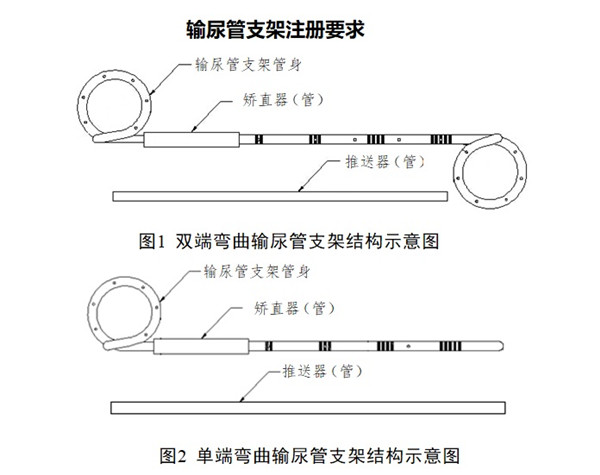
輸尿管支架注冊要求及審評要點:
1.輸尿管支架注冊產品的結構及組成
輸尿管支架通常由硅橡膠��、聚氨酯或其他聚合物制造��,單端或雙端有環(huán)狀彎曲����,可包含推送器(管)、矯直器(管)�、導絲等配件,也可含有縫線�����、涂層���、顯影材料等結構��。輸尿管支架可按形狀(單端彎曲或雙端彎曲)�����、長度���、管徑等不同分為若干型號與規(guī)格�����,以無菌形式提供�����。放置于腎盂與膀胱之間�����,用于對人體輸尿管進行支撐和引流�����。體內滯留時間小于30天。
2.輸尿管支架注冊產品技術要求的主要性能指標
產品技術要求的制訂應符合《醫(yī)療器械產品技術要求編寫指導原則》的要求����。企業(yè)應根據(jù)自身產品的技術特征和臨床使用情況來確定產品安全有效的性能指標和檢驗方法。對宣稱的產品的所有技術參數(shù)和功能��,應在產品技術要求中予以規(guī)定��。輸尿管支架產品的部分檢驗方法���,可參考相應行業(yè)標準YY/T 0872《輸尿管支架試驗方法》�����。若對標準中的試驗方法有所修改�����,應說明修改的內容及原因��,并提交驗證資料��。通常應考慮(但不限于)以下性能指標���。
2.1物理性能:
2.1.1外觀
2.1.2尺寸
2.1.3固定強度
2.1.4斷裂強度
2.1.5伸長率
2.1.6動態(tài)摩擦力(適用于聲稱“低摩擦”的產品)
2.1.7與配件的配合性能
2.1.8耐彎曲
2.1.9縫線結合強度(適用于帶縫線可取出的產品)
2.2化學性能:
2.2.1 pH
2.2.2重金屬
2.2.3紫外吸光度
2.2.4還原物質
2.2.5蒸發(fā)殘渣
2.2.6用環(huán)氧乙烷滅菌的產品應規(guī)定環(huán)氧乙烷殘留量的要求�。
2.2.7由硅橡膠制成的產品可參考YY 0334《硅橡膠外科植入物通用要求》制訂產品的化學性能要求�����。
2.3無菌�����。
2.4細菌內毒素(如適用)。
2.5如產品包含相關配件���,還應制訂配件的性能指標��。如金屬導絲的耐腐蝕等���。
3.輸尿管支架注冊單元劃分的原則
根據(jù)《醫(yī)療器械分類目錄》及有關的分類界定文件,產品管理類別為Ⅱ類�����,分類編碼為14-05-05�。
醫(yī)療器械產品的注冊單元原則上以技術結構、性能指標和預期用途為劃分依據(jù)���。不同原材料���、不同技術結構產品應劃分為不同醫(yī)療器械注冊單元�����。
例如:硅橡膠材料和聚氨酯材料制成的輸尿管支架應劃分為不同注冊單元�����。