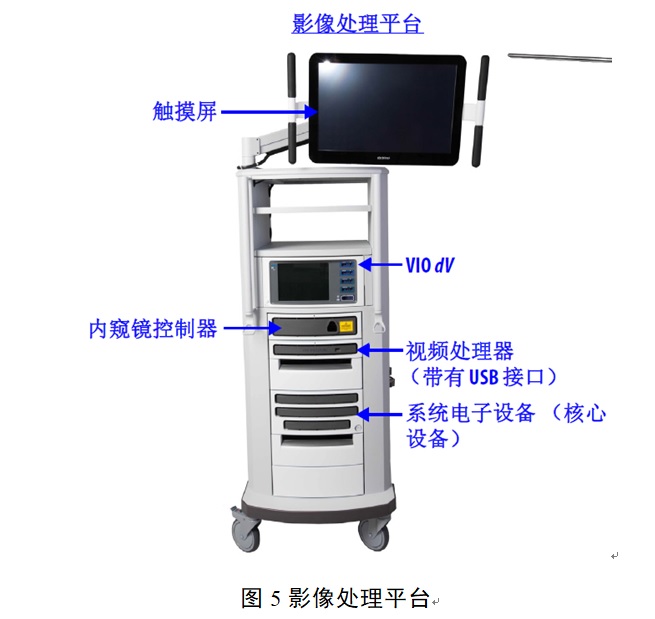
多孔腹腔內(nèi)窺鏡手術系統(tǒng)(簡稱手術系統(tǒng))通常包括醫(yī)生控制臺����、患者手術平臺、影像處理平臺����、三維腹腔內(nèi)窺鏡(簡稱內(nèi)窺鏡)、手術器械等�。按現(xiàn)行《醫(yī)療器械分類目錄》���,該類產(chǎn)品在我國屬于第三類醫(yī)療器械注冊產(chǎn)品����,分類編碼為01-07-03。本文為大家說說腹腔內(nèi)窺鏡手術系統(tǒng)臨床試驗設計要點及注意事項����。
多孔腹腔內(nèi)窺鏡手術系統(tǒng)(簡稱手術系統(tǒng))通常包括醫(yī)生控制臺、患者手術平臺�����、影像處理平臺�����、三維腹腔內(nèi)窺鏡(簡稱內(nèi)窺鏡)�����、手術器械等�。按現(xiàn)行《醫(yī)療器械分類目錄》,該類產(chǎn)品在我國屬于第三類醫(yī)療器械注冊產(chǎn)品�,分類編碼為01-07-03。本文為大家說說腹腔內(nèi)窺鏡手術系統(tǒng)臨床試驗設計要點及注意事項�。
1.臨床試驗目的
為確認腹腔內(nèi)窺鏡手術系統(tǒng)輔助醫(yī)生開展手術的安全性和有效性,可采取多種方法�,包括模型試驗、動物試驗和臨床試驗等�����。注冊申請人在充分的模型試驗、動物試驗確認產(chǎn)品性能和安全性的基礎上�����,科學合理的開展臨床試驗設計��。此時��,臨床試驗目的為確認產(chǎn)品輔助醫(yī)生開展腔鏡手術的有效性和安全性�。
2.臨床試驗總體設計
腹腔內(nèi)窺鏡手術系統(tǒng)為通用手術工具類產(chǎn)品,輔助醫(yī)生完成手術操作����,常用于泌尿外科、普通外科���、婦科和胸外科(以下簡稱“臨床常見科室”)腔鏡手術�。產(chǎn)品注冊時��,注冊申請人可在上述科室選擇代表性的常見術式開展臨床試驗���,用于支持臨床常見科室的注冊申報���。臨床試驗可采用前瞻性、單組目標值設計��。
3.入排標準
受試者是經(jīng)過培訓的醫(yī)生按照臨床診療規(guī)范確定的�����、擬接受腹腔內(nèi)窺鏡手術系統(tǒng)輔助進行泌尿�����、普外����、婦科和胸外代表性術式的患者。其他入選標準和排除標準的具體內(nèi)容由申辦方和研究者具體討論決定��。
4.評價指標和隨訪時間
(1)主要終點
主要有效性終點是手術未中轉(zhuǎn)率����,將“手術未中轉(zhuǎn)”定義為未從腹腔內(nèi)窺鏡手術系統(tǒng)輔助方法轉(zhuǎn)換為其他腹腔內(nèi)窺鏡手術系統(tǒng)輔助、腹腔鏡下手術或者開放性手術����。
主要安全性終點是從第一個切口到術后30天符合Clavien-Dindo分級系統(tǒng)3級或以上標準的與器械相關的或可能相關的并發(fā)癥發(fā)生率�����。
(2)次要終點
包括手術時間�、術中估計失血量(mL)��、患者疼痛評分��、輸血率�����、器械缺陷發(fā)生率��、住院時間��、從第一個切口到術后30天的整體并發(fā)癥發(fā)生率(Clavien-Dindo 1級或以上)�����、不良事件和嚴重不良事件發(fā)生率以及30天內(nèi)再入院率�����、再次手術率和死亡率等。
5.臨床試驗樣本量
臨床試驗開始前�����,注冊申請人需全面收集具有一定質(zhì)量水平及相當數(shù)量病例的同類產(chǎn)品的臨床數(shù)據(jù)��,經(jīng)科學分析(如Meta分析等)���,構(gòu)建臨床試驗的目標值(性能目標),包括靶值和單側(cè)置信區(qū)間界限(通常為97.5%單側(cè)置信區(qū)間界限)��。注冊申請人需提交目標值的確定依據(jù)和支持性資料����。
例如,若經(jīng)過科學分析���,該類產(chǎn)品在臨床常見科室手術未發(fā)生中轉(zhuǎn)的比例可接受的最低標準為90%���,申報產(chǎn)品預期手術未發(fā)生中轉(zhuǎn)的比例為99%,在雙側(cè)顯著性水平0.05�����、把握度80%、脫落率10%時����,采用精確概率法進行樣本量估算,臨床試驗的樣本量為60例�。若行業(yè)可接受該類產(chǎn)品在臨床常見科室的術后30天Clavien-Dindo3級或以上標準的并發(fā)癥發(fā)生率最低標準為16%,申報產(chǎn)品上述并發(fā)癥預期發(fā)生率為3%�,在雙側(cè)顯著性水平0.05、把握度80%����、脫落率10%時,采用精確概率法進行樣本量估算���,臨床試驗的樣本量為48例��。綜上�,臨床試驗的樣本量為60例�����。
當注冊申請人已通過臨床試驗確認該產(chǎn)品在一定適用范圍(如泌尿外科���,普外科特定術式)內(nèi)的有效性和安全性后��,若在已有適用范圍上增加預期使用科室時��,鼓勵申請人通過非臨床研究�����、臨床試驗確認產(chǎn)品的安全有效性��,單科室臨床試驗的樣本量建議為15例左右�。
6.臨床試驗術式
臨床試驗需覆蓋適用范圍內(nèi)的常見代表性術式��。代表性術式通常為更高風險/更復雜的術式��,對申報科室常見術式所能到達的手術工作區(qū)���、目標組織類型(如實質(zhì)組織�、空腔組織��、脈管組織等)及其涵蓋的手術任務(如抓取�、切割、縫合���、凝結(jié)�����、牽引����、剝離、結(jié)扎等)具有覆蓋性��。
注冊申請人申請臨床常見科室時��,臨床試驗中需包括:(1)泌尿外科:腎部分切除術(經(jīng)腹腔或后腹膜)�����、根治性前列腺切除術���;(2)婦科:子宮根治性切除術加盆腔淋巴結(jié)清掃術���;(3)普通外科:遠端胃癌根治術、結(jié)直腸癌根治術����、肝切除術/脾切除術;(4)胸外科:肺段/肺葉切除術��、食管癌根治術等。
各科室樣本量分布需基本均衡���。已上市產(chǎn)品增加預期使用科室時���,可參考上述要求選擇代表性術式。若注冊申請人采取其他代表性術式����,需基于前述代表性術式的定義論證其合理性。
7.統(tǒng)計分析
可參考《醫(yī)療器械臨床試驗設計指導原則》對臨床試驗結(jié)果進行統(tǒng)計分析��,得出結(jié)論����。