PMDA 全稱為Pharmaceuticals and Medical Devices Agency�����, 其日語名稱翻譯為“獨(dú)立行政法人醫(yī)藥品醫(yī)療器械綜合機(jī)構(gòu)”, 是厚生勞動省醫(yī)藥食品局所管轄的獨(dú)立行政法人�。PMDA 的業(yè)務(wù)主要包括審查、安全對策����、健康損害救濟(jì)三大板塊。
摘要:PMDA 全稱為Pharmaceuticals and Medical Devices Agency�, 其日語名稱翻譯為“獨(dú)立行政法人醫(yī)藥品醫(yī)療器械綜合機(jī)構(gòu)”, 是厚生勞動省醫(yī)藥食品局所管轄的獨(dú)立行政法人。PMDA 的業(yè)務(wù)主要包括審查���、安全對策����、健康損害救濟(jì)三大板塊,截至2017 年 4 月 1 日的數(shù)據(jù)顯示�,審查、安全對策��、健康損害救濟(jì)業(yè)務(wù)分別有員工 578�、190、39 名��,其中 2014 年4 月公布的負(fù)責(zé)醫(yī)療器械注冊審查人員數(shù)量為 104 名�����。PMDA 的組織機(jī)構(gòu)圖見圖1����,其中第一個理事及其分支為審查相關(guān)的業(yè)務(wù)部門。PMDA 的主要業(yè)務(wù)如下:
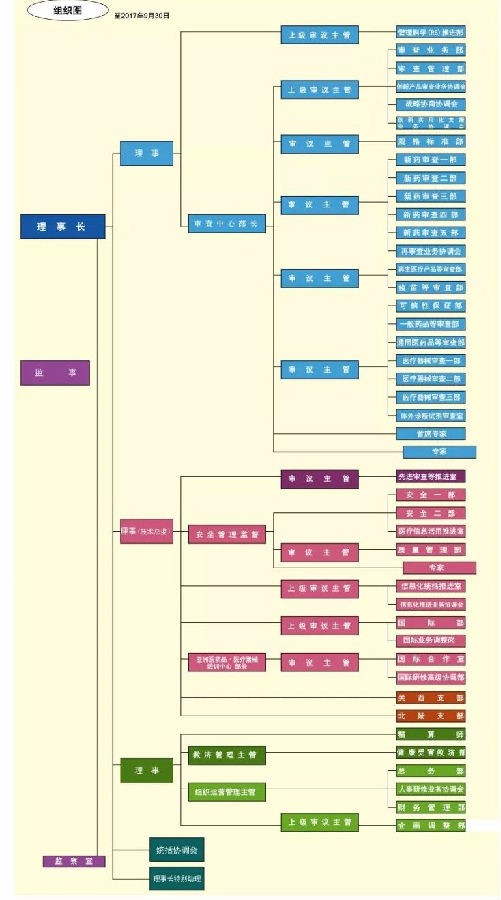
圖1 PMDA 組織機(jī)構(gòu)圖
一�����、 審查
審查業(yè)務(wù)旨在管控風(fēng)險、降低風(fēng)險��,是上市前對產(chǎn)品安全有效性的審核���,審查業(yè)務(wù)包括臨床試驗(yàn)和其他問題的咨詢����,對藥品����、醫(yī)療器械和再生醫(yī)療產(chǎn)品的合規(guī)性審查�����、再審查 / 再評價 , 針對按法規(guī)要求實(shí)施的試驗(yàn)的科學(xué)性���、倫理性進(jìn)行調(diào)查(GCP/GLP/GPSP 符合性評估), 生產(chǎn)過程和設(shè)施的 GMP/QMS/GCTP 檢查 , 已注冊認(rèn)證機(jī)構(gòu)的檢查 , 標(biāo)準(zhǔn)的制修訂等�。
根據(jù)新版《藥事法》�����,對初次獲得批準(zhǔn)的醫(yī)療器械���,經(jīng)一定時期后��,要進(jìn)行再審查�。新設(shè)計的、結(jié)構(gòu)新穎的或采用新原理的醫(yī)療器械��,在獲得初次批準(zhǔn)后第四年�����,接受再審查����。具有新效力、新用途或新性能的醫(yī)療器械����,則在獲得初次批準(zhǔn)后第三年,接受再審查��。
自 2015 年 10 月醫(yī)療器械審查部門實(shí)行新體制��,由原來兩個審查部調(diào)整為三個����,分工見表 1。
表 1醫(yī)療器械審查部門分工
審查 部門 | 領(lǐng)域 | 品種 |
一部 | 機(jī)器人、ICT(InformationandCommunicationTechnology信息和通信技術(shù))及其他領(lǐng)域 | 機(jī)器人技術(shù)�、先進(jìn)的ICT技術(shù)等創(chuàng)新醫(yī)療器械、多科室醫(yī)療器械等 |
矯形�、整形領(lǐng)域 | 人工關(guān)節(jié)、接骨用品�����、創(chuàng)傷包裹材料等 |
二部 | 精神�、神經(jīng)、呼吸���、腦���、血管領(lǐng)域 | 血管支架�、人工呼吸系統(tǒng)等 |
消化、生殖系統(tǒng)領(lǐng)域 | 消化系統(tǒng)支架���、膠囊內(nèi)窺鏡��、透析設(shè)備��、泌尿系統(tǒng)醫(yī)療器械���、婦產(chǎn)科設(shè)備等 |
牙科口腔領(lǐng)域 | 牙科用植入體�、齲齒治療����、補(bǔ)牙材料等 |
三部 | 眼科、耳鼻科領(lǐng)域 | 眼內(nèi)鏡���、人工耳蝸等 |
心肺循環(huán)系統(tǒng)領(lǐng)域 | 輔助人工心臟���、冠狀動脈支架等 |
同時設(shè)有八個跨部門的小組,包括:
?�。?)臨床評價小組����;
(2)生物學(xué)安全小組�;
(3)電氣安全小組(含激光)�;
(4)軟件小組(含網(wǎng)絡(luò)安全應(yīng)對)���;
?����。?)后發(fā)小組(包括合作計劃:實(shí)質(zhì)等同的明確化)��;
?��。?)國際應(yīng)對小組�����,含IMDRF(International Medical Device RegulatorsForum���,國際醫(yī)療器械監(jiān)管者論壇);
?。?)監(jiān)管科學(xué)小組(監(jiān)管科學(xué)案例策劃、與監(jiān)管科學(xué)推進(jìn)部的協(xié)調(diào)����,以及對非其他小組管轄的監(jiān)管科學(xué)案件的應(yīng)對)�;
(8)再生醫(yī)療制品審查部�、生物源器械辦公室(生物源制品的安全性評價)。
二����、安全對策
安全對策業(yè)務(wù)是指上市后的安全措施����,旨在持續(xù)性降低風(fēng)險��,是PMDA 與厚生省一同協(xié)作�,為了保證醫(yī)療器械的安全、放心使用而實(shí)施��。PMDA 與厚生省從制造商����、經(jīng)銷商、醫(yī)療機(jī)構(gòu)等處收集與醫(yī)療器械產(chǎn)品質(zhì)量����、有效性、安全性相關(guān)的信息����,并對收集的信息進(jìn)行科學(xué)的調(diào)查、探討��,形成的安全對應(yīng)策略���。根據(jù)各項(xiàng)規(guī)定要求����,在 PMDA 官網(wǎng)上不僅可以查到審查相關(guān)的資料,同時可以查到緊急安全性信息�����、關(guān)于醫(yī)療安全信息的通知等�。
三、健康損害救濟(jì)
健康損害救濟(jì)旨在為醫(yī)療領(lǐng)域健康已受到的傷害采取救助措施���,此業(yè)務(wù)與審評審批業(yè)務(wù)關(guān)系不大��,因此本文未深入研究探討�。
四�、PMDA 的承認(rèn)審查
1. 新醫(yī)療器械:與已批準(zhǔn)的醫(yī)療器械在結(jié)構(gòu)組成、使用方法���、效果及性能方面有明顯差異的醫(yī)療器械���。
2. 改良醫(yī)療器械:不屬于新醫(yī)療器械或后發(fā)醫(yī)療器械的醫(yī)療器械�。
3. 后發(fā)醫(yī)療器械:被認(rèn)為與已批準(zhǔn)的醫(yī)療器械在結(jié)構(gòu)組成���、使用方法、功能�、效果及性能等有等同性的醫(yī)療器械,即與已批準(zhǔn)醫(yī)療器械在構(gòu)造�、使用方法、效果及性能本質(zhì)上等同的產(chǎn)品��,申請認(rèn)證或承認(rèn)時不需要提供臨床試驗(yàn)數(shù)據(jù)���。
新醫(yī)療器械與改良醫(yī)療器械一般無相應(yīng)的審查標(biāo)準(zhǔn)�����,無論風(fēng)險等級為Ⅱ�、Ⅲ還是Ⅳ級�����,均由 PMDA 進(jìn)行審評����,厚生省承認(rèn)。自 2009 年起�����,對于已有審查標(biāo)準(zhǔn)的后發(fā)醫(yī)療器械,可由第三方認(rèn)證機(jī)構(gòu)認(rèn)證����;無審查標(biāo)準(zhǔn)的后發(fā)醫(yī)療器械仍由 PMDA 審評,厚生省承認(rèn)�����。根據(jù) PMDA 公開的 2016 年度工作 報 告 中 的 數(shù) 據(jù)��,2014~2016 年 度PMDA 審評的各類醫(yī)療器械數(shù)量見表 2��。
表 2 PMDA2014~2016 年度承認(rèn)的醫(yī)療器械數(shù)量
年度注1 / 類型 | 2014 年度 | 2015 年度 | 2016 年度 |
新醫(yī)療器械注2 | 67 (5) | 56 (8) | 26 (1) |
改良醫(yī)療器械注3 | 248 (35) | 293 (53) | 269 (44) |
后發(fā)醫(yī)療器械 | 917 | 868 | 825 |
注:1.日本的財政年度采取跨歷年制��,從當(dāng)年4月1日至下年的3月31日止��,例如2016年度指2016年4月1日至2017年3月31日����;
2.括號中數(shù)字為優(yōu)先品種數(shù)量;
3.括號中數(shù)字為開展臨床試驗(yàn)的品種數(shù)量���。
日本醫(yī)療器械獲得承認(rèn)的流程見圖2:
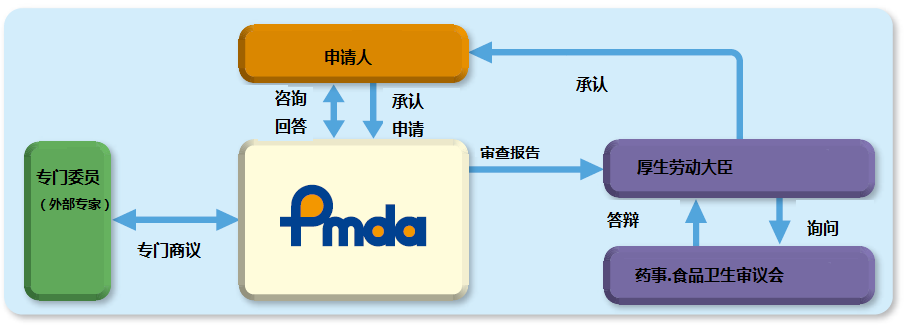
圖2 醫(yī)療器械承認(rèn)流程圖
專門委員由 PMDA 從各學(xué)科中經(jīng)驗(yàn)豐富者中選出并任命 , 名單在PMDA 網(wǎng)站公布���。與專門委員商議的制度與我中心的專家咨詢制度類似�����,有信函商議和會議商議兩種方式,2016 年度共計開展了 71 次信函商議�����,17 次會議商議�。