FDA發(fā)布醫(yī)療器械唯一標識 (UDI) 的形式和內(nèi)容指南文件
發(fā)布日期:2021-11-14 14:02瀏覽次數(shù):3257次
近年來,全球醫(yī)療器械主流市場監(jiān)管機構����,無論是NMPA、歐盟�,還是FDA,都在致力于推動�����、推廣醫(yī)療器械唯一標識UDI在醫(yī)療器械全生命周期中的應用����。近日,F(xiàn)DA發(fā)布《醫(yī)療器械唯一標識系統(tǒng):醫(yī)療器械唯一標識? (UDI) 的形式和內(nèi)容》指南文件�����,一起來了解一下���。
近年來,全球醫(yī)療器械主流市場監(jiān)管機構���,無論是NMPA��、歐盟�����,還是FDA���,都在致力于推動��、推廣醫(yī)療器械唯一標識UDI在醫(yī)療器械全生命周期中的應用�����。近日����,F(xiàn)DA發(fā)布《醫(yī)療器械唯一標識系統(tǒng):醫(yī)療器械唯一標識 (UDI) 的形式和內(nèi)容》指南文件�,一起來了解一下。
2021年7月7日���, FDA發(fā)布《醫(yī)療器械唯一標識系統(tǒng):醫(yī)療器械唯一標識 (UDI) 的形式和內(nèi)容》文件���。該文件不適用于通用產(chǎn)品代碼,旨在協(xié)助貼標者和 FDA 認證簽發(fā)機構遵守醫(yī)療器械唯一標識 (Unique Device Identifier ,UDI ) 標簽要求�����,包括闡明 FDA 對 21 CFR 801.40 下某些要求的解讀�����。描述關于 UDI 形式和內(nèi)容要求���,以及 FDA 的建議����,以確保根據(jù) UDI發(fā)布系統(tǒng)開發(fā)的 UDI ��,符合醫(yī)療器械唯一標識系統(tǒng)最終規(guī)則 78 FR 58786(2013 年 9 月 24 日)的目的?����,F(xiàn)就有關內(nèi)容概述如下:
1.背景
UDI 規(guī)則要求每個醫(yī)療器械的標簽和器械包裝均帶有 UDI��,除非有例外情況或替代方案適用 (21 CFR 801.20)����。如果器械預期使用超過一次,并計劃在每次使用前再處理�,則部分器械需要在器械本身貼附永久性標記,提供 UDI (21 CFR 801.45)���。根據(jù) UDI 規(guī)則�����,每個貼標者必須使用一個或多個經(jīng) FDA 認證簽發(fā)機構運作的系統(tǒng)���,其指定 UDI 顯示在器械標簽、器械包裝上���,如適用�����,可在設備上直接標記(21 CFR 801.20�、801.45 和 830.20)�。
UDI 必須在器械標簽和器械包裝上以兩種形式呈現(xiàn):(1) 易讀純文本;(2) 自動識別和數(shù)據(jù)采集 (automatic identification and data capture ����,AIDC) 技術 (21 CFR 801.40(a))����。當器械必須帶有 UDI 作為直接標記時����,UDI 可以通過易讀純文本或/和 AIDC 技術形式提供,或通過任何可按需提供器械 UDI 的替代技術提供 (21 CFR 801.45(c))��。
2.醫(yī)療器械唯一標識 (UDI)
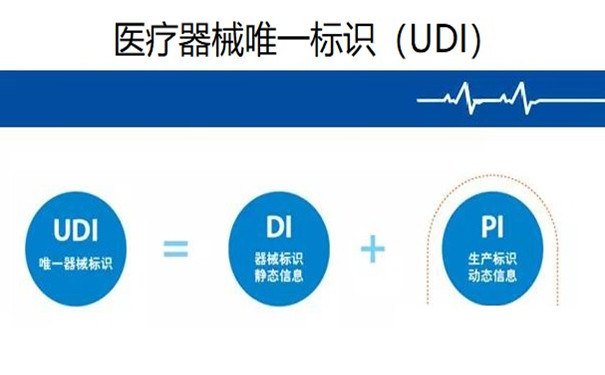
“醫(yī)療器械唯一標識”定義為“通過滿足 [21 CFR 830.20] 的要求�,在分發(fā)和使用期間可以正確識別某種器械的一種標識符” (21 CFR 801.3)。UDI 由器械標識符 (device identifier ���,DI) 和生產(chǎn)標識符 (production identifier ��,PI) 組成��?!捌餍禈俗R符”定義為 “UDI 的強制固定組成部分��,用于識別器械的特定版本或型號以及器械的貼標者” (21 CFR 801.3)��?!吧a(chǎn)標識符”在 21 CFR 801.3 中的定義為 “UDI 的視條件可改變的部分,當出現(xiàn)在器械標簽上時�,該部分用于識別下列一項或多項內(nèi)容:
(i) 制造器械的批號或批次�����;
(ii) 特定器械的序列號;
(iii) 特定器械的到期日期�;
(iv) 特定器械的生產(chǎn)日期;
(v) 對于作為器械監(jiān)管的 HCT/P�,本章 21 CFR 1271.290(c) 要求的獨特識別碼。
根據(jù) 21 CFR 830.20����,UDI 必須通過 FDA 認證簽發(fā)機構運作的系統(tǒng)簽發(fā),并符合以下 21 CFR 830.10 通過引用納入到 UDI 規(guī)則的國際標準:
ISO/IEC 15459-2:信息技術 - 唯一標識——第 2 部分:注冊程序�����;
ISO/IEC 15459-4:信息技術 - 唯一標識——第 4 部分:單個項目��;
ISO/IEC 15459-6:信息技術 - 唯一標識——第 6 部分:產(chǎn)品分組的唯一標識���。
此外�,UDI 只能使用 ISO/IEC 646 恒定字符集的字符和數(shù)字:信息技術 - 用于信息交換的 ISO 7 位編碼字符集�����。每個 FDA 認證簽發(fā)機構必須開發(fā)并運作一個符合 21 CFR 第 801 部分 B 子部分下 UDI 標簽要求的 UDI 分配系統(tǒng),使貼標者能夠放心使用 FDA 認證簽發(fā)機構系統(tǒng)分配的符合這些要求的 UDI�����。
2.1 UDI 的形式
器械標簽和器械包裝上的 UDI 必須以易讀純文本和 AIDC 技術形式呈現(xiàn) (21 CFR 801.40(a))�����。
此外�����,某些器械需要根據(jù) 21 CFR 801.45 直接標記���。對于這些器械�����,可通過易讀純文本或/和 AIDC 技術����,或任何可按需提供器械 UDI 的替代技術直接在器械上標記 UDI (21 CFR 801.45(c))�。
UDI(尤其通過 AIDC 技術提供時)旨在快速、準確的實現(xiàn)數(shù)據(jù)采集����、記錄和檢索���。易讀純文本形式使醫(yī)務人員、患者�、FDA 和 UDI 系統(tǒng)的其他用戶能夠在無技術協(xié)助的情況下閱讀 UDI 并將其輸入數(shù)據(jù)系統(tǒng),例如患者記錄或交給 FDA 的報告����。因此����,如果無法使用 AIDC 形式,則易讀純文本形式可用作采集 UDI 的附加機制���。
2.2 易讀純文本
“易讀純文本”指 UDI 數(shù)據(jù)字符的人類易讀解釋����,其形式必須包括 DI�;如適用,還應包括 PI����。UDI 的易讀純文本形式還需要包括任何數(shù)據(jù)分隔符�。UDI 的易讀純文本形式可能顯示為單行或多行文本�����,并應顯示在 UDI 的 AIDC 技術形式下方或附近����。
2.3 AIDC
AIDC 在 21 CFR 801.3 中的定義為通過自動化流程以可輸入電子患者記錄或其他計算機系統(tǒng)的形式傳輸器械 UDI 或 UDI DI 部分的任何技術。UDI 的 AIDC 形式必須采用條形碼掃描儀或其他 AIDC 技術可讀取的格式 (21 CFR 801.3 和 801.40(a))�。貼標者應確保在分發(fā)和使用期間需要識別器械信息時,能夠有效讀取 UDI 的 AIDC 形式�。貼標者應參考其合作 FDA 認證簽發(fā)機構的指南,以確定簽發(fā)機構的 UDI 系統(tǒng)支持哪些形式的 AIDC���。FDA 建議將 UDI 的 AIDC 形式顯示在一個符段中�����;但是���,其可能會分成多個符段。貼標者可以選擇在單個器械標簽�、器械包裝或器械上使用多種類型的 AIDC 技術(如適用),以協(xié)助可能采用不同 UDI 采集技術方法的用戶。
如果貼標者選擇一種 AIDC 條形碼形式��,則應測試 UDI 的條形碼形式的印刷質(zhì)量�。FDA 建議參考以下標準和技術參考,了解有關確定印刷質(zhì)量的更多信息:
ISO/IEC 15416: 信息技術——自動識別和數(shù)據(jù)采集技術——條形碼印刷質(zhì)量測試規(guī)范——線狀符號�����;
ISO/IEC 15415: 信息技術——自動識別和數(shù)據(jù)采集技術——條形碼符號印刷質(zhì)量測試規(guī)范——二維符號��;
ISO/IEC TR 29158: 信息技術——自動識別和數(shù)據(jù)采集技術——直接部件標記 (DPM) 質(zhì)量指南�����。
如果用于傳達 UDI 的 AIDC 技術形式在目視檢查器械標簽或器械包裝時不明顯����,則器械標簽或器械包裝必須披露是否使用了 AIDC 技術�����。FDA 建議�,如果使用符合 21 CFR 801.15(c) 的符號,則貼標者應考慮使用國際公認的符號�。
2.4 UDI 的內(nèi)容
UDI 載體可能包括有關器械的其他非 UDI 信息。FDA 認為這些額外的非 UDI 元素不屬于 UDI 的一部分,其他非 UDI 元素的數(shù)據(jù)分隔符應與 UDI 中的 DI 和 PI 數(shù)據(jù)分隔符區(qū)分����。器械標識符段和生產(chǎn)標識符段不得包含非 UDI 元素或非 UDI 元素的數(shù)據(jù)分隔符。UDI 規(guī)則不要求標簽上包含 PI 的五個標識符中的任何一個��。但是�,其他法規(guī)可能要求標簽上包含 PI 的一個或多個標識符。在某些情況下���,UDI 可能僅包含 DI����。I 類器械的 UDI 不需要包含 PI (21 CFR 801.30(d))�����。
2.5 數(shù)據(jù)分隔符
“數(shù)據(jù)分隔符”指定義的數(shù)據(jù)字符或數(shù)據(jù)字符集��,用于識別 UDI 載體中表示的編碼數(shù)據(jù)串中的特定數(shù)據(jù)元素����。用于識別緊隨其后的信息,并且根據(jù)不同 FDA 認證簽發(fā)機構建立的 UDI 系統(tǒng)而有所不同�。
數(shù)據(jù)分隔符是 UDI 易理解度和實用度的關鍵�。數(shù)據(jù)分隔符指示并區(qū)分 UDI 載體中表示的數(shù)據(jù)串中的每個數(shù)據(jù)元素����,且納入數(shù)據(jù)分隔符對于 UDI 的易讀純文本和 AIDC 形式都很重要。數(shù)據(jù)分隔符允許用戶以 UDI 的易讀純文本形式分析 DI 和 PI��,并驗證在 UDI 的 AIDC 形式中編碼的信息與 UDI 的易讀純文本形式相匹配����。
數(shù)據(jù)分隔符還能夠?qū)崿F(xiàn) UDI 在掃描后解析到電子系統(tǒng)中。數(shù)據(jù)分隔符允許將 UDI 與 UDI 載體中可能表示的任何非 UDI 元素區(qū)分并分別采集�����。如果 UDI 載體中包含非 UDI 元素�,則應納入這些非 UDI 元素的單獨數(shù)據(jù)分隔符。如果沒有適當?shù)臄?shù)據(jù)分隔符來識別非 UDI 元素�����,個人可能無法使用 UDI 的易讀純文本形式來識別器械�,計算機系統(tǒng)可能無法通過自動化流程準確捕獲 AIDC 形式的 UDI�。
2.6 UDI 載體易讀純文本形式的數(shù)據(jù)順序
在易讀純文本形式中,UDI 應先于任何非 UDI 元素�����。排序為首先指定 DI,然后指定 PI(如有)����。如果 UDI 載體中有任何非 UDI 元素,則非 UDI 元素應位于作為 UDI 易讀純文本形式一部分的 PI 之后��。雖然 FDA 不禁止在 UDI 載體中納入數(shù)量�����,但數(shù)量不被視為 UDI 的一部分�����,且數(shù)量的數(shù)據(jù)分隔符應與 UDI 中的 DI 和 PI 數(shù)據(jù)分隔符區(qū)分�。
2.7 獨立軟件
獨立軟件的標簽要求有所不同,具體取決于其是否以包裝形式分發(fā) (21 CFR 801.50)�。對于未以包裝形式分發(fā)的獨立軟件,如果通過以下任一種或兩種形式提供 UDI���,且版本號已在其 PI 中表示���,則符合 UDI 標簽要求:
軟件啟動時顯示的易讀純文本聲明��;或通過菜單命令顯示的易讀純文本聲明 (21 CFR 801.50(a))�。
對于以包裝形式分發(fā)的獨立軟件���,21 CFR 801.50(a) 不適用����。獨立軟件必須提供 UDI�,作為軟件啟動時或通過菜單命令顯示的易讀純文本聲明 (21 CFR 801.50(b))。器械標簽���、器械包裝必須同時帶有易讀純文本和 AIDC 形式的 UDI (21 CFR 801.20(a) 和 801.40(a))���。當器械標簽上包含制造器械的批號或批次時,該批號或批次必須包含在 PI 中 (21 CFR 801.3 和 801.40(b))�����?!败浖姹尽卑?21 CFR 801.3 的批號或批次定義中。當需要帶有 UDI 的獨立軟件的貼標者在標簽上納入軟件版本時����,必須通過 PI 顯示 (21 CFR 801.3,801.50(b)���;另見 78 FR 58794)���。
以上是對FDA該文件主要內(nèi)容的簡介。對其進行研究探討����,有助于借鑒國際先進經(jīng)驗和工作方式,提高我國醫(yī)療器械的監(jiān)管效率�,從而更好地促進我國醫(yī)療器械行業(yè)的發(fā)展。