內(nèi)蒙古自治區(qū)第二類醫(yī)療器械注冊流程和要求
發(fā)布日期:2020-08-04 18:04瀏覽次數(shù):3300次
內(nèi)蒙古自治區(qū)第二類醫(yī)療器械注冊流程和要求��,詳見正文��。
引言:內(nèi)蒙古自治區(qū)第二類醫(yī)療器械注冊流程和要求�,詳見正文����。

一、內(nèi)蒙古自治區(qū)第二類醫(yī)療器械注冊受理條件:
1.已在內(nèi)蒙古自治區(qū)轄區(qū)內(nèi)依法登記的企業(yè)��。 2.已確定申報產(chǎn)品為第二類醫(yī)療器械����,申報注冊的產(chǎn)品已經(jīng)列入《醫(yī)療器械產(chǎn)品分類目錄》的第二類醫(yī)療器械或者國家總局界定文件中明確為第二類醫(yī)療器械的產(chǎn)品;對于新研制的尚未列入分類目錄的醫(yī)療器械�����,經(jīng)國家總局確認為二類醫(yī)療器械的產(chǎn)品���。 3.已具備擬注冊產(chǎn)品的生產(chǎn)能力����,按照醫(yī)療器械生產(chǎn)質(zhì)量管理規(guī)范的相關(guān)要求建立與產(chǎn)品研制、生產(chǎn)有關(guān)的質(zhì)量管理體系并保持有效運行�����; 申請注冊時樣品不得委托其他企業(yè)生產(chǎn)��,按照創(chuàng)新醫(yī)療器械特別審批程序?qū)徟漠a(chǎn)品除外��。 4.辦理醫(yī)療器械注冊申請的人員具有相應(yīng)的專業(yè)知識����,熟悉醫(yī)療器械注冊管理的法規(guī)、規(guī)章和有關(guān)的技術(shù)要求�����。 5.申請人申請注冊�����,應(yīng)當遵循醫(yī)療器械安全有效基本要求���,保證研制過程規(guī)范�,所有數(shù)據(jù)真實��、完整、可溯源����。 6.申請注冊的資料應(yīng)當使用中文。根據(jù)外文資料翻譯的���,應(yīng)當同時提供原文。引用未公開發(fā)表的文獻資料時���,應(yīng)當提供資料所有者許可使用的證明文件��。申請人對資料的真實性負責(zé)�����。 7.申報資料齊全���,符合申報材料要求及相關(guān)法律法規(guī)的規(guī)定條件。 8.對于國家食品藥品監(jiān)督管理總局已發(fā)布相應(yīng)產(chǎn)品注冊技術(shù)指導(dǎo)原則��,申請人應(yīng)參照執(zhí)行����。
二�、內(nèi)蒙古自治區(qū)第二類醫(yī)療器械注冊流程:
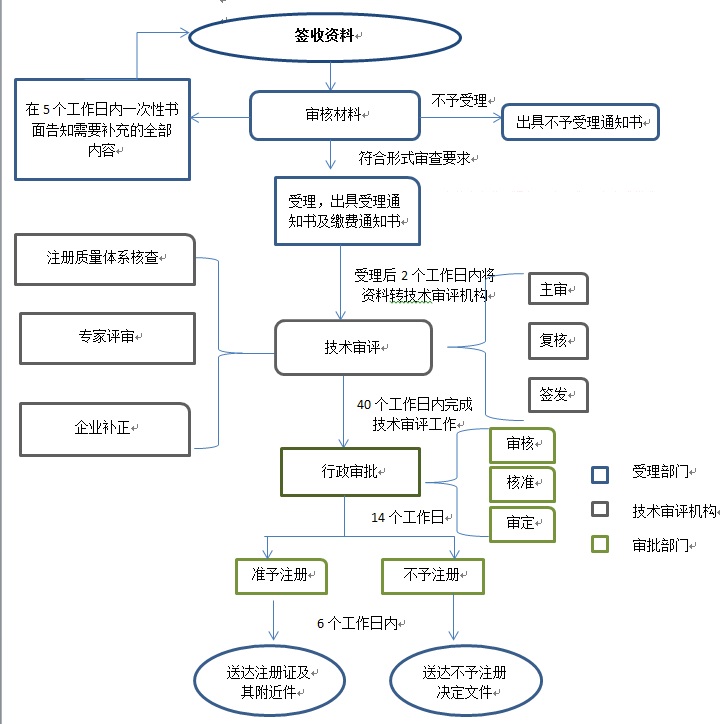
上一篇:沒有了
下一篇:沒有了