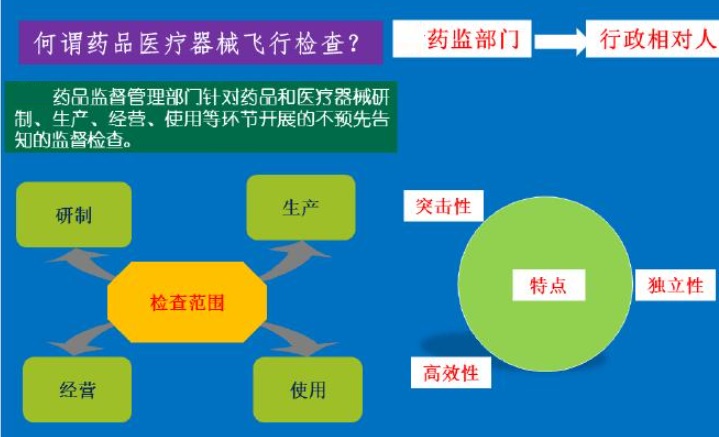
飛行檢查是藥品監(jiān)管部門針對行政相對人開展的不預(yù)先告知的監(jiān)督檢查���,具有突擊性、獨立性�����、高效性等特點���,目的是檢查企業(yè)醫(yī)療器械生產(chǎn)質(zhì)量管理方面的即時 狀況或真實情況�。按照政府信息公開的要求��,及時向社會公布抽查結(jié)果 以及被抽查對象違法處理情況��,充分發(fā)揮社會和新聞 媒體的監(jiān)督作用���。
飛行檢查是藥品監(jiān)管部門針對行政相對人開展的不預(yù)先告知的監(jiān)督檢查����,具有突擊性����、獨立性、高效性等特點,目的是檢查企業(yè)醫(yī)療器械生產(chǎn)質(zhì)量管理方面的即時 狀況或真實情況�。按照政府信息公開的要求,及時向社會公布抽查結(jié)果 以及被抽查對象違法處理情況���,充分發(fā)揮社會和新聞 媒體的監(jiān)督作用�。
政策法規(guī):2006年��,國家食品藥品監(jiān)管局發(fā)布了《藥品GMP飛行檢查暫行規(guī)定》�����,2012年發(fā)布《醫(yī)療器械生產(chǎn)企業(yè)飛行檢查工作程序(試行)》���,在調(diào)查問題��、管控風險����、震懾違法行為等方面發(fā)揮了重要作用�����。為適應(yīng)監(jiān)管形勢變化和需要�����,經(jīng)過深入調(diào)研和廣泛征求意見���,總局對飛行檢查的范圍�、要求����、工作程序以及各方責任和義務(wù)做出進一步明確,在此基礎(chǔ)上���,起草和制定了《藥品醫(yī)療器械飛行檢查辦法》�?�!掇k法》共5章35條�����,包括總則���、啟動����、檢查、處理及附則����。
辦法特點 :《辦法》主要體現(xiàn)了五大特點:一是規(guī)范飛行檢查的啟動和實施,充分體現(xiàn)依法獨立原則���。例如���,《辦法》規(guī)定了通過投訴舉報、檢驗��、不良反應(yīng)監(jiān)測發(fā)現(xiàn)產(chǎn)品可能存在質(zhì)量安全風險等可以啟動飛行檢查的七種情形����。二是建立風險研判和分層處理措施,解決風險有效管控的問題�。《辦法》按照風險不同分層設(shè)計了風險管控措施���。例如檢查過程中����,對需要立即采取暫停產(chǎn)品生產(chǎn)�����、銷售�、使用或者召回等風險控制措施的,檢查組應(yīng)當立即報請組織實施部門及時作出處理決定�����。三是強調(diào)全方位多層次的銜接配合�,建立順暢的協(xié)調(diào)機制?����!掇k法》明確要求組織飛行檢查的食品藥品監(jiān)督管理部門應(yīng)當加強對檢查工作的指揮���?�?筛鶕?jù)現(xiàn)場檢查反饋的情況啟動食品藥品監(jiān)管相關(guān)部門的應(yīng)對協(xié)調(diào)機制�����;可聯(lián)合公安機關(guān)等有關(guān)部門共同開展飛行檢查���;可要求被檢查單位所在地食品藥品監(jiān)管部門派員協(xié)助檢查���。四是豐富和細化應(yīng)對手段,提升飛行檢查的可操作性和權(quán)威性�。例如《辦法》對被檢查單位“拒絕、逃避監(jiān)督檢查”的不配合情形進行了細化��,明確這些情形構(gòu)成《藥品管理法實施條例》�、《醫(yī)療器械監(jiān)督管理條例》等有關(guān)規(guī)定的行政處罰從重情節(jié)。五是落實監(jiān)管部門職責�,強化執(zhí)法監(jiān)督?��!掇k法》除明確地方監(jiān)管部門的協(xié)助配合義務(wù)外����,還規(guī)定食品藥品監(jiān)管部門應(yīng)當對飛行檢查情況予以公開的原則和信息通報與報告的義務(wù)
醫(yī)療器械飛行檢查要點:
醫(yī)療器械飛行檢查的過程中發(fā)現(xiàn)的問題主要集中在:機構(gòu)與人員管理���,廠房與設(shè)施設(shè)備管理�,文件管理��,設(shè)計開發(fā)��,采購��,生產(chǎn)管理,質(zhì)量控制管理�,銷售和售后服務(wù),不合格品控制����,不良事件監(jiān)測�����、分析和改進�����。
機構(gòu)與人員管理主要體現(xiàn)在公司的架構(gòu)不清晰�����,人員搬動沒有及時登記���,關(guān)鍵崗位監(jiān)管人員直至不符��,人員培訓(xùn)不到位�����,對法律法規(guī)不清楚回答不上來現(xiàn)場抽查人員的提問�����。個別與產(chǎn)品直接接觸人員為按要求進行年度體檢等�,需要加強系統(tǒng)化規(guī)范性管理。廠房與設(shè)施設(shè)備管理發(fā)現(xiàn)的問題較多:不能夠嚴格按照生產(chǎn)規(guī)范GMP的要求去做����,設(shè)備出現(xiàn)壞損不及時更換維修,廠房溫濕度�,整潔度不達要求在潔凈車間洗滌間等處的水池和地漏,采用無水 封直排方式排水��,難以防止微生物的侵入��。倉儲區(qū)域沒有按要求進行分區(qū)管理導(dǎo)設(shè)置區(qū)域標識致混亂以及危險品亂放����。為建立生產(chǎn)設(shè)備使用記錄檔案,查氣象色譜儀自帶的使用記錄有170213B-00的記錄 ��,企業(yè)制訂的紙質(zhì)使用記錄中未記錄上述編號記錄���。
文件管理部也是企業(yè)集中出現(xiàn)問題的地方:
1��、企業(yè)的《質(zhì)量手冊》的內(nèi)容按照藥品生產(chǎn)質(zhì)量管 理規(guī)范編寫����,缺少醫(yī)療器械法規(guī)及醫(yī)療器械生產(chǎn)質(zhì)量 管理規(guī)范的要求。
2�、部分生產(chǎn)過程的操作規(guī)程或作業(yè)指導(dǎo)書未按文件 要求發(fā)放到相關(guān)生產(chǎn)操作崗位。
3���、文件更新沒有評審和批準記錄,如:納米銀醫(yī)用 抗菌敷料產(chǎn)品標準從2008年版升級為2016年版�����,未能 提供文件更新的評審和批準記錄��。
4����、未按文件控制程序的要求更新外來文件《醫(yī)療器 械監(jiān)督管理條例》(國務(wù)院令第680號)、《醫(yī)療器 械召回管理辦法》(局令第29號)等�����。
5、原材料檢驗記錄存在隨意涂改的現(xiàn)象�。
6、產(chǎn)品生產(chǎn)相關(guān)記錄未逐臺進行歸檔�,不易檢索。
生產(chǎn)管理環(huán)節(jié)是企業(yè)最重要的一個環(huán)節(jié)也是最容易出現(xiàn)問題的地方��,生產(chǎn)過程中的細節(jié)以及操作是否規(guī)范決定了產(chǎn)品的最終質(zhì)量����,也決定了公司的未來以及存亡。
問題主要集中在:企業(yè)提供的生產(chǎn)工藝流程未有效識別關(guān)鍵工序和 特殊過程��,并進行有效管理�,驗證或確認報告不能有 效指導(dǎo)操作。現(xiàn)場檢查半成品 ����,生產(chǎn)隨工卡空白,沒有按生產(chǎn)進程記���。生產(chǎn)記錄缺少原材料分子篩批號���、主要設(shè)備等內(nèi)容。企業(yè)生產(chǎn)記錄相關(guān)規(guī)程中只明確了產(chǎn)品機身號的 編碼規(guī)則��,未明確生產(chǎn)日期如何確定,也未明確生產(chǎn) 日期和機身碼之間的關(guān)聯(lián)���。
生產(chǎn)記錄無產(chǎn)品規(guī)格型號�、數(shù)量��、生產(chǎn)日期等; 生產(chǎn)記錄中調(diào)試工序相關(guān)記錄信息不全����,未包含主要 設(shè)備、工藝參數(shù)等內(nèi)容�����。企業(yè)實施受控的《產(chǎn)品批號管理規(guī)定》未詳細對 產(chǎn)品的滅菌批號編制方法進行規(guī)定����。生產(chǎn)管理環(huán)節(jié)的不規(guī)范跟質(zhì)量控制脫不了關(guān)系:企業(yè)制定的檢驗規(guī)程及檢驗記錄與產(chǎn)品注冊標準 中規(guī)定不一致���,未建立質(zhì)控品臺賬�����,只有使用記錄�,未記錄來源 和效期等信息。試驗用朗道常規(guī)校準物使用記錄中無保存溫度和 過期產(chǎn)品處理記錄�����。如:生產(chǎn)設(shè)備“精密擠出機”的溫控儀校準證已過期���,未定期校準�����?�!?8.3.1 企業(yè)成品檢驗報告未包含產(chǎn)品注冊標準中出廠檢 驗項目的相關(guān)內(nèi)容等�。所以做好質(zhì)量管控關(guān)卡保證生產(chǎn)過程的規(guī)范是做好產(chǎn)品的前提����。
銷售以及售后服務(wù)方面也是極易出現(xiàn)問題的地方
主要體現(xiàn)在資料的不完成:1、銷售記錄無產(chǎn)品名稱���、生產(chǎn)批號�、購貨單位�、地 址、聯(lián)系方式等內(nèi)容����,產(chǎn)品銷售記錄缺項多����,不能滿 足追溯要求�����。2����、銷售記錄缺少產(chǎn)品編號或序列號、有效期����、銷售 日期、聯(lián)系方式等內(nèi)容����。3�、企業(yè)未建立經(jīng)銷商管理規(guī)程,未規(guī)定應(yīng)查驗經(jīng)銷 商(顧客)的資質(zhì)文件��,并由企業(yè)法規(guī)部門參與評審 經(jīng)銷商訂單(正?�;蛱厥庖?guī)格)的合法合規(guī)性。所以一定要做好銷售環(huán)節(jié)的審查與監(jiān)管工作���,確保能夠及時清晰有效的追蹤溯源�,確保流通環(huán)節(jié)的透明清晰�。
處罰不是目的,而是為了讓企業(yè)繃緊合規(guī)守法的那根弦����,把患者的利益放在第一位。隨著國家的監(jiān)管力度逐漸加大�,飛檢也將成為常態(tài)化這就企業(yè)從細微做起嚴格按照GMP規(guī)范要求去做合格的產(chǎn)品,有社會責任感和有擔當?shù)钠髽I(yè)����。
標簽:醫(yī)療器械飛行檢查要點