為幫助醫(yī)療器械注冊申請人更好地理解法規(guī)����、規(guī)章��、指導原則等配套文件的要求�,上海器審中心統(tǒng)計了2022年度上海市第二類醫(yī)療器械注冊技術審評發(fā)補中的常見問題(無源醫(yī)療器械),并進行了歸類與剖析��,以幫助注冊申請人提高注冊申報資料的科學性與合規(guī)性��,提高注冊申報的質量和效率�����。
為幫助醫(yī)療器械注冊申請人更好地理解法規(guī)�����、規(guī)章����、指導原則等配套文件的要求,上海器審中心統(tǒng)計了2022年度上海市第二類醫(yī)療器械注冊技術審評發(fā)補中的常見問題(無源醫(yī)療器械)��,并進行了歸類與剖析��,以幫助注冊申請人提高注冊申報資料的科學性與合規(guī)性���,提高注冊申報的質量和效率����。
一、2022年上海市第二類無源醫(yī)療器械注冊常見問題發(fā)補統(tǒng)計
2022年度�����,上海市器審中心共受理無源產品注冊申報共249件����。其中首次注冊發(fā)補率為100%,變更注冊發(fā)補率為43.47%����,延續(xù)注冊發(fā)補率為33.7%。
按照《關于公布醫(yī)療器械注冊申報資料要求和批準證明文件格式的公告》(2021年第121號)的申報資料架構���,小編將發(fā)補內容進行了歸類和整理���。首次發(fā)布內容的發(fā)補率見下表。
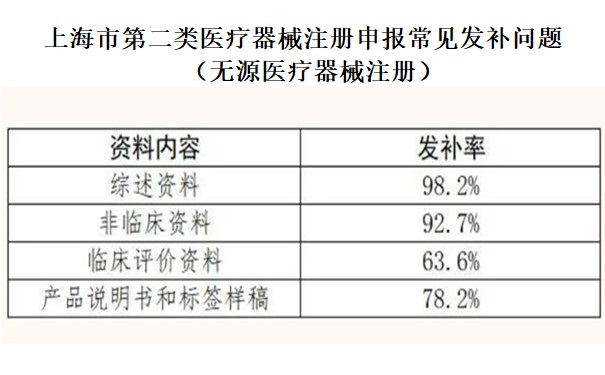
二�、2022年上海第二類醫(yī)療器械注冊常見發(fā)補問題分析(無源器械)
(一)綜述資料常見發(fā)補問題
1.醫(yī)療器械注冊單元
根據(jù)《醫(yī)療器械注冊單元劃分指導原則》的規(guī)定,產品的技術原理���、結構組成�、性能指標、適用范圍不同時��,原則上劃分為不同注冊單元�����。例如�����,“液體敷料”存在西林瓶和預灌裝注射器兩種包裝形式�,產品在結構組成����、使用方法存在較大差異,建議作為不同的注冊單元進行注冊申報�����。
2.產品名稱
產品名稱不符合《醫(yī)療器械通用名稱命名規(guī)則》和《醫(yī)療器械通用名稱命名指導原則》��。例如�����,“血栓抽吸連接管”應修改為“一次性使用吸引連接管”。
3.產品作用機理
產品的作用原理描述含糊不清�,未提供詳細的作用機理說明或是各部件在產品中的功能、各組件連接方式�����。例如����,“導引鞘組”的各組件如何配合以實現(xiàn)產品的預期用途,建議給出產品原理圖和清晰示意圖���。
4.適用范圍
產品的適用范圍不規(guī)范���,未能根據(jù)分類目錄、分類界定文件��、免臨床評價目錄�、已上市同類產品和產品臨床使用情況,規(guī)范產品適用范圍����。例如,“負壓吸引連接管”與負壓吸引泵配合使用�,根據(jù)臨床實際使用在適用范圍中明確配套使用的負壓源情況��,給出產品能夠承受的最大負壓值����。
5.結構組成
產品的結構組成不明確���,未能提供清晰示意圖。建議明確產品的具體結構���,提交產品示意圖�����,標注主要尺寸和組件名稱以及產品各組成部分的清晰圖片��。
6.型號規(guī)格
產品型號規(guī)格的設定依據(jù)不足�����、不同規(guī)格之間的劃分不明確�����,不同型號規(guī)格之間的差異描述不清楚�。例如,“潤滑劑”規(guī)格從5mL到1000mL��,需要補充提交臨床應用依據(jù)����,建議采用對比產品表對不同規(guī)格型號的結構組成、功能����、性能指標加以描述。
7.原材料
缺少產品原材料符合相關標準的支持性資料�。建議提供每個組件的原材料詳細信息,包括原材料的等級規(guī)格�����、質量標準����、供應商和入廠檢驗要求;若生產過程中含有溶劑�、粘結劑、添加劑等��,應進一步明確。原材料如為液體�,建議提供配比依據(jù),不同配方可能影響產品的基本性能�。
(二)非臨床資料常見發(fā)補問題
1.產品技術要求
型號規(guī)格常見問題主要是:未明確型號規(guī)格劃分依據(jù)。性能指標發(fā)補問題有:①產品技術要求中的產品性能指標低于適用的國家標準/行業(yè)標準���;②未采用最新發(fā)布的國家標準����、行業(yè)標準�;③與國行標不一致或有缺漏適用項�����;④檢驗方法與國家/行業(yè)標準不一致且未提交充分驗證依據(jù)��。
2.檢驗報告
檢驗報告的典型性覆蓋問題較為常見��,如送檢樣品未能覆蓋全部的型號規(guī)格���,建議除選擇典型型號進行全性能檢驗外�����,還應選擇其他型號進行差異性能檢驗��。
3.性能研究
①申請人往往對于產品技術要求中的性能指標的研究�,僅提供了部分化學和物理性能編制研究資料。例如��,企業(yè)提供了性能指標的確定依據(jù)�����,但未提供性能驗證方案和報告��;②申請人未能提供對于產品安全性���、有效性存在一定影響���,但未納入產品技術要求的性能指標中的其他性能研究資料,例如:“一次性使用導引鞘”除產品技術要求中的性能指標外��,還應補充提交模擬使用相關的研究資料�����,如推送性能���、扭轉性能�、回撤性能、抗彎折性能�、抗扭結性能等;
4.生物相容性研究
①產品的生物相容性研究評價依據(jù)���、接觸時間和與人體接觸的性質等不明確����,如僅提供原材料生物學試驗報告��,并非成品的生物學試驗報告����;②試驗樣品不具有代表性��,如鼻塞導管僅選用成人型為代表型號�����,該型號未覆蓋嬰兒型號的膠體貼片(直接接觸嬰兒皮膚)����。
5.滅菌研究
①提交的滅菌研究資料不完整,如:企業(yè)未能根據(jù)GB 18279系列標準提交滅菌確認方案和報告、環(huán)氧乙烷的解析驗證方案及報告���、相關過程記錄附件���;②所選滅菌產品不能代表注冊單元內的所有規(guī)格型號;③企業(yè)未能詳細描述過程挑戰(zhàn)裝置(IPCD和EPCD)的制備方法���、明確BI的放置位置及最難滅菌位置的確定依據(jù)�����;④關于滅菌產品的追加�����,應根據(jù)GB 18279系列標準和YY/T 1268-2015《環(huán)氧乙烷滅菌的產品追加和過程等效》評估滅菌確認的產品是否能列入同一滅菌處理組��,并提供論證性資料����,必要時應對滅菌組內的所有產品及其內部挑戰(zhàn)裝置進行短周期抗性對比試驗以確認最難滅菌的產品�;不同滅菌柜也應提交等效性驗證資料;⑤產品經全周期滅菌后應對產品性能和包裝性能進行檢測��。如:企業(yè)未檢測滅菌后產品和包裝的全性能指標。
6.有效期和包裝研究
①應依據(jù)《無菌醫(yī)療器械包裝試驗方法第1部分:加速老化試驗指南》(YY/T 0681.1)對產品(包括包裝)采用加速老化試驗和實時老化試驗的方式驗證其有效期�����;②老化驗證報告應包括但不限于�����,加速老化起止時間�、加速老化設備、老化產品批號����,并明確產品零時刻的檢驗報告和終時刻的檢驗報告;③進行有效期驗證的產品應能代表注冊單元內的所有型號規(guī)格�����;④產品有效期驗證的檢測性能應包含產品技術要求中的所有性能和包裝性能�����,明確性能指標和檢測方法����,提交測試記錄,并對加速老化過程中產品性能的變化進行分析��。⑤產品包裝驗證可依據(jù)有關標準進行(如GB/T 19633���、YY/T 0681.1等)�,提交產品的包裝驗證報告�。直接接觸產品的包裝材料的選擇應至少考慮以下因素:包裝材料的物理化學性能;包裝材料的毒理學特性����、包裝材料與產品的適應性、包裝材料與成型和密封過程的適應性�、包裝材料與標簽系統(tǒng)的適應性、包裝材料與貯存運輸過程的適應性��。
(三)臨床評價資料常見發(fā)補問題
1.免臨床評價目錄
根據(jù)《免于臨床評價醫(yī)療器械目錄》內容�,注冊申請人應提交申報產品與目錄產品的對比資料,包括結構組成�、材質、適用范圍等信息��。
2.通過同品種臨床評價路徑進行臨床評價
對于與境內已上市產品的對比項目中��,應對其結構差異���、型號規(guī)格���、預期用途等進行詳細的分析評價��,論證存在的差異是否會產生不同的安全有效性問題�����,并提供科學依據(jù)和支持性資料���。同時,建議注冊申報人的比對資料詳細完整����,不要使用“無明顯差異”“基本等同”等模糊描述,對差異部分應進行詳細論述�。
(四)產品說明書和標簽樣稿常見發(fā)補問題
醫(yī)療器械產品說明書可參考以下具體文件《醫(yī)療器械說明書和標簽管理規(guī)定》、標準(強標���、專標)及注冊技術審查指導原則對說明書的要求����。常見發(fā)補問題如下:說明書中性能指標與產品技術要求不一致�����;說明書中描述內容�、適用范圍與綜述資料、研究資料不一致���;未涵蓋《醫(yī)療器械說明書和標簽管理規(guī)定》中要求的內容或描述不清晰����。
三�����、上海市2022年第二類醫(yī)療器械變更注冊常見發(fā)補問題分析(無源器械)
醫(yī)療器械變更注冊最常見發(fā)補問題是對變更內容的驗證和確認不夠充分��,或表述不規(guī)范�����。大部分問題與前文首次注冊常見問題相同�����,不再贅述����。變更注冊特有的發(fā)補內容如下:
(一)綜述資料常見發(fā)補問題
企業(yè)應根據(jù)產品具體變更情況提供相應的說明及對比表:型號規(guī)格變化�、產品名稱變化��、產品技術要求變化��、結構及組成變化���、產品適用范圍變化等�。特別注意如果新增型號規(guī)格與原有型號規(guī)格在結構組成���、性能指標����、適用范圍等方面有顯著差異���,不能作為同一注冊單元進行變更注冊�����。
(二)研究資料常見發(fā)補問題
涉及新增型號規(guī)格�,需提交臨床設計的依據(jù),及相應的性能研究�、滅菌研究、有效期研究���、臨床評價等方面的資料;涉及部件材料發(fā)生變化��,需提交成品性能研究報告����、有效期驗證方案和報告,必要時提供生物學評價報告�;涉及變更滅菌方式,應提供生物相容性研究資料��,以評估滅菌方式的改變是否會影響產品的生物相容性���。
四����、上海市2022年第二類醫(yī)療器械器械延續(xù)注冊常見發(fā)補問題分析(無源器械)
延續(xù)注冊發(fā)補最主要問題是執(zhí)行的強制性標準�����、《中華人民共和國藥典》版本已修訂,但申請人未在產品技術要求中補充新要求并提供證明產品符合新要求的檢驗報告���。該情況下�����,會在形式審查階段發(fā)出補正意見����。申請人應持續(xù)關注新的強制性標準發(fā)布情況����,確保相關條款符合國家標準要求后再行延續(xù)注冊申報。
五�����、總結與討論
本文對2022年上海市第二類體無源器械注冊申報常見發(fā)補問題進行了系統(tǒng)的梳理和分析�。無源產品種類繁多,確認和驗證的過程較復雜�,對申請人能力要求較高。申請人應深刻理解�����、準確把握相關指導原則中的具體要求,再實施驗證和確認�,避免發(fā)補后重新進行驗證,造成時間與資源的浪費�。產品技術要求、產品說明書����、文字描述的規(guī)范性�����、與注冊申報資料的一致性應高度重視�����,仔細斟酌���。由于新發(fā)布的《關于公布醫(yī)療器械注冊申報資料要求和批準證明文件格式的公告(2021年第121號)》對綜述資料有了更具體的要求��,申請人應予以相應關注����,避免出現(xiàn)資料完整性的問題����。
標簽:上海第二類醫(yī)療器械注冊��、上海第二類醫(yī)療器械延續(xù)注冊��、上海第二類醫(yī)療器械變更注冊